
【题目】在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3molN气体混合,发生如下反应:![]()
![]() ,该反应达平衡时,生成
,该反应达平衡时,生成![]() R,并测得Q的浓度为
R,并测得Q的浓度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是![]()
A.x值为2B.混合气体的密度增大
C.平衡时N的浓度为![]()
![]() D.N的转化率为
D.N的转化率为![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
(1)若温度不变,加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同);若该溶液升高温度,下列表达式的数据增大的是________。
A c(H+)
B c(H+)c(OH-)
C 
D 
(2)某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁a、b胶头滴管的胶头,观察实验现象

①装置A、B中用红墨水而不用水的目的是________________。
②实验刚开始时,发现装置A中的长导管液面上升得比装置B中的要快。则胶头滴管a中盛的是__________。 两装置反应结束时(无固体剩余)。静置后两装置中的长导管或面均有所下降,最终液面高度__________(填“相等”。“A中的高”或“B中的高”).
(3)实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也是显著强于纯水。又知液态纯酸都能像水那样进行自身电离而建立平衡。且在一定温度下都有各自的离子积常数。据此回答:
①5°C时,液态纯硫酸的离子积常数K(H2SO4)_____1×10-14(填“>”“<”或“=”).
②在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________。
(4)在某温度下的水溶液中,c(H+)=10xmolL-1,c(OH-)=10ymolL-1,x与y的关系如图所示:

①该温度下,水的离子积为____________。
②该温度下,0.01 molL-1 NaOH溶液中水电离出c(OH-)为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() L的密闭容器内,物质D在
L的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是

A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
![]()
B.根据如图该反应的平衡常数表达式为![]()
C.若在第5min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大
D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示。下列说法正确的是( )
的数据如图所示。下列说法正确的是( )
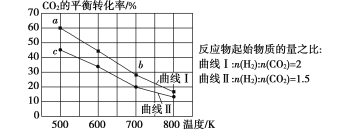
A.该反应的![]()
B.达到平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为90%
的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展储氢技术是氢氧燃料电池推广应用的关键.研究表明液氨是一种良好的储氢物质,其储氢容量可达![]()
![]() 质量分数
质量分数![]() 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:![]()
请回答下列问题:

![]() 氨气自发分解的反应条件是 ______ .
氨气自发分解的反应条件是 ______ .
![]() 已知:
已知:![]()
![]()
![]()
![]()
则,反应![]()
![]() 的
的![]() ______ .
______ .
![]() 研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
①不同催化剂存在下,氨气分解反应的活化能最大的是 ______ ![]() 填写催化剂的化学式
填写催化剂的化学式![]() .
.
②恒温![]() 恒容时,用Ni催化分解初始浓度为
恒容时,用Ni催化分解初始浓度为![]() 的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率
的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率![]() 随时间t变化的关系曲线
随时间t变化的关系曲线![]() 如图
如图![]() 请在图2中画出:在温度为
请在图2中画出:在温度为![]() ,Ru催化分解初始浓度为
,Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 随t变化的总趋势曲线
随t变化的总趋势曲线![]() 标注
标注![]() ______
______
③如果将反应温度提高到![]() ,请如图2中再添加一条Ru催化分解初始浓度为
,请如图2中再添加一条Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 的总趋势曲线
的总趋势曲线![]() 标注
标注![]() ______
______
④假设Ru催化下温度为![]() 时氨气分解的平衡转化率为
时氨气分解的平衡转化率为![]() ,则该温度下此分解反应的平衡常数K与
,则该温度下此分解反应的平衡常数K与![]() 的关系式是:
的关系式是:![]() ______ .
______ .
![]() 用Pt电极对液氨进行电解也可产生
用Pt电极对液氨进行电解也可产生![]() 和
和![]() 阴极的电极反应式是 ______ ;阳极的电极反应式是 ______
阴极的电极反应式是 ______ ;阳极的电极反应式是 ______ ![]() 已知:液氨中
已知:液氨中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在 200℃左右时供电( 如 下 图 所 示 ), 比 甲 醇 电 池 效 率 高 出 32 倍 , 且 比 较 安 全 。 电 池 总 反 应 为C2H5OH+3O2==2CO2+3H2O。则下列说法正确的是( )
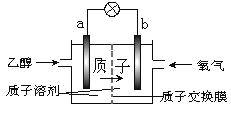
A.a 极为电池的正极
B.电池正极的电极反应:O2 + 4H+ + 4e- = 2H2O
C.电池工作时电子由 b 极沿导线经灯泡再到 a 极
D.溶液中 H+ 向 a 电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗CuO制备CuCl2晶体的流程如下:
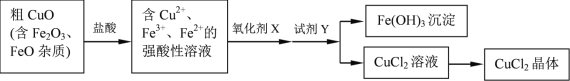
各种离子相关数据如下:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.0 | 4.7 | 1.9 |
完全转化成氢氧化物沉淀时的pH | 9.0 | 6.7 | 3.2 |
请回答:
(1)CuO溶于盐酸的离子方程式是_______________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
① NaClO溶液显_______性(填“酸”或“碱”)。你认为用NaClO作氧化剂X是否妥当__________(填“是”或“否”),理由是__________。
②下列另有几种常用的氧化剂,可用作氧化剂X的是__________。
a 浓H2SO4 b C12 c H2O2
(3)试剂Y的作用是调节溶液的pH=3.2,将Fe3+转化为Fe(OH)3沉淀,过滤后得到CuCl2溶液。下列试剂中适宜的是___________。
a NaOH b Na2CO3 c CuCO3 d CuO
(4)为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·min)B.v(D)=1mol/(L·min)
C.v(C)=0.8mol/(L·min)D.v(B)=0.3mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com