
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;2NaCl+H2SO4![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;Na2SO4+4C![]() Na2S+4CO↑
Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;Na2S+CaCO3![]() Na2CO3+CaS
Na2CO3+CaS
下列说法正确的是( )
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上在一定条件下可利用反应I和II来制备:
(1)已知在25°C、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则表示燃烧热的热化学方程式为___
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L密闭容器中,CH4(g)+H2O(g)CO(g)+3H2(g)(I)CH4的转化率与温度、压强的关系如图所示:

①该反应的△H__0,△S__0(填“<”、“>”或“=”);
②已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为___,该反应的平衡常数为___(mol·L-1)2。
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___(填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大 D.再充入amolCO和3amolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1 mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为___________。
(2)B为0.1 mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入_____________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_______________。
(4)某酸H2B在水溶液中有如下变化:H2B![]() H++HB-;HB-
H++HB-;HB-![]() H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:_________________________
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是__________0.11 mol·L-1(填“<”,“>”,或“=”),理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应![]() ,达平衡后,温度一定时,将气体体积缩小到原来的
,达平衡后,温度一定时,将气体体积缩小到原来的![]() ,当达新平衡时,C的浓度为原来的
,当达新平衡时,C的浓度为原来的![]() 倍,则下列推断正确的是
倍,则下列推断正确的是![]()
A.平衡向正向移动了
B.![]()
C.达新平衡时,A的浓度小于原平衡A浓度的2倍
D.达新平衡时,容器内总压一定比原平衡的2倍小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔化学奖获得者乔治·欧拉教授率领团队首次采用金属钌作催化剂,从空气中捕获CO2直接转化为甲醇,为通往未来“甲醇经济”迈出了重要一步,并依据该原理开发如图所示转化。
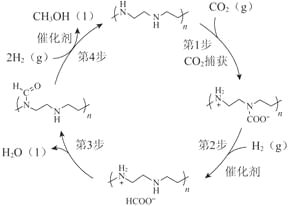
(1)CO2中含有的化学键类型是_________键。
(2)将生成的甲醇(沸点为64.7℃)与水分离可采取的方法是_________。
(3)上图所示转化中,由第1步至第4步的反应热(ΔH)依次是a kJ/mol、b kJ/mol、c kJ/mol、d kJ/mol,则该转化总反应的热化学方程式是_________。
(4)500℃时,利用金属钌做催化剂,在固定容积的密闭容器中可直接实现如(3)中转化得到甲醇。测得该反应体系中X、Y浓度随时间变化如图。
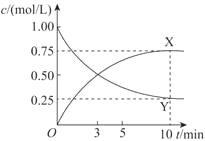
①Y的化学式是_________,判断的理由是_________。
②下列说法正确的是_________(选填字母)。
A.Y的转化率是75% |
B.其他条件不变时,若在恒压条件下进行该反应,Y的转化率高于75% |
C.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应 |
D.金属钌可大大提高该反应中反应物的转化率 |
③从反应开始到平衡,用氢气表示的平均反应速率v(H2) =_________mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个固定容积均为1L密闭容器中以不同的氢碳比![]() 充入
充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]() 的平衡转化率
的平衡转化率![]() 与温度的关系如图所示.下列说法正确的是
与温度的关系如图所示.下列说法正确的是![]()
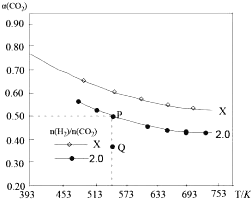
A.该反应在高温下自发进行
B.X的氢碳比![]() ,且Q点在氢碳比为
,且Q点在氢碳比为![]() 时
时![]()
C.若起始时,![]() 、
、![]() 浓度分别为
浓度分别为![]() 和
和![]() ,则可得到P点,对应温度的平衡常数的值为512
,则可得到P点,对应温度的平衡常数的值为512
D.向处于P点状态的容器中,按2:4:1:4的比例再充入![]() 、
、![]() 、
、![]() 、
、![]() ,再次平衡后
,再次平衡后![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3molN气体混合,发生如下反应:![]()
![]() ,该反应达平衡时,生成
,该反应达平衡时,生成![]() R,并测得Q的浓度为
R,并测得Q的浓度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是![]()
A.x值为2B.混合气体的密度增大
C.平衡时N的浓度为![]()
![]() D.N的转化率为
D.N的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com