
【题目】诺贝尔化学奖获得者乔治·欧拉教授率领团队首次采用金属钌作催化剂,从空气中捕获CO2直接转化为甲醇,为通往未来“甲醇经济”迈出了重要一步,并依据该原理开发如图所示转化。
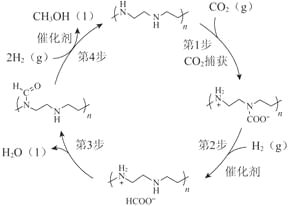
(1)CO2中含有的化学键类型是_________键。
(2)将生成的甲醇(沸点为64.7℃)与水分离可采取的方法是_________。
(3)上图所示转化中,由第1步至第4步的反应热(ΔH)依次是a kJ/mol、b kJ/mol、c kJ/mol、d kJ/mol,则该转化总反应的热化学方程式是_________。
(4)500℃时,利用金属钌做催化剂,在固定容积的密闭容器中可直接实现如(3)中转化得到甲醇。测得该反应体系中X、Y浓度随时间变化如图。
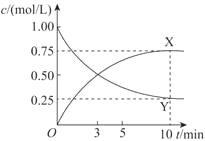
①Y的化学式是_________,判断的理由是_________。
②下列说法正确的是_________(选填字母)。
A.Y的转化率是75% |
B.其他条件不变时,若在恒压条件下进行该反应,Y的转化率高于75% |
C.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应 |
D.金属钌可大大提高该反应中反应物的转化率 |
③从反应开始到平衡,用氢气表示的平均反应速率v(H2) =_________mol/(L·min)。
【答案】极性共价键 蒸馏 CO2(g) + 3H2(g)![]() CH3OH(l) + H2O(l) ΔH=(a+b+c+d) kJ/mol CO2 Y随反应进行浓度减小,因此Y为反应物,且其相同时间内转化量与X相同,则其在方程式中的化学计量数应与X相同,因此Y是CO2 abc 0.225 mol/(L·min)
CH3OH(l) + H2O(l) ΔH=(a+b+c+d) kJ/mol CO2 Y随反应进行浓度减小,因此Y为反应物,且其相同时间内转化量与X相同,则其在方程式中的化学计量数应与X相同,因此Y是CO2 abc 0.225 mol/(L·min)
【解析】
(1)CO2中含有极性共价键,故答案为极性共价;
(2)甲醇(沸点为64.7℃)与水的沸点不同,所以用蒸馏的方法分离,故答案为蒸馏;
(3)根据盖斯定律,可知反应热的大小与起态和始态有关与过程无关,所以该转化总反应的热化学方程式是CO2(g)+3H2(g)CH3OH(l)+H2O(l)△H=(a+b+c+d) kJ/mol,故答案为CO2(g)+3H2(g)CH3OH(l)+H2O(l)△H=(a+b+c+d) kJ/mol;
(4)①由图可知X的量在增加,Y的量再减少,而且变化量相同,所以Y是反应物,而且计量数与生成物的计量数相同,所以Y是CO2,故答案为CO2;Y随反应进行浓度减小,因此Y为反应物,且其相同时间内转化量与X相同,则其在方程式中的化学计量数应与X相同,因此Y是CO2;
②a.Y的转化率是![]() ×100%=75%,故正确;b.因为正反应是气体体积减少的反应,所以其他条件不变时,若在恒压条件下进行该反应,相当于增大压强,Y的转化率变大,故正确;c.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应,故正确;d.催化剂只改变反应的速率,但平衡不移动,故错误;故选abc;
×100%=75%,故正确;b.因为正反应是气体体积减少的反应,所以其他条件不变时,若在恒压条件下进行该反应,相当于增大压强,Y的转化率变大,故正确;c.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应,故正确;d.催化剂只改变反应的速率,但平衡不移动,故错误;故选abc;
③v(CO2)=![]() =0.075mol/(Lmin),而v(H2)=
=0.075mol/(Lmin),而v(H2)=![]() v(CO2)=0.225 mol/(Lmin),故答案为0.225。
v(CO2)=0.225 mol/(Lmin),故答案为0.225。


科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态,生成0.8mol D,并测得C的浓度为0.4mol/L。由此推断:
(1)x值等于______________
(2)B的平衡浓度为_____________
(3)A的转化率为____________
(4)生成D的反应速率______________
(5)如果增大反应体系的压强,则平衡体系中C的质量分数____________(填“增大”或“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
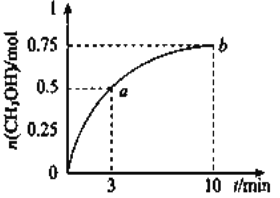
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() L的密闭容器内,物质D在
L的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是

A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
![]()
B.根据如图该反应的平衡常数表达式为![]()
C.若在第5min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大
D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展储氢技术是氢氧燃料电池推广应用的关键.研究表明液氨是一种良好的储氢物质,其储氢容量可达![]()
![]() 质量分数
质量分数![]() 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:![]()
请回答下列问题:

![]() 氨气自发分解的反应条件是 ______ .
氨气自发分解的反应条件是 ______ .
![]() 已知:
已知:![]()
![]()
![]()
![]()
则,反应![]()
![]() 的
的![]() ______ .
______ .
![]() 研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
①不同催化剂存在下,氨气分解反应的活化能最大的是 ______ ![]() 填写催化剂的化学式
填写催化剂的化学式![]() .
.
②恒温![]() 恒容时,用Ni催化分解初始浓度为
恒容时,用Ni催化分解初始浓度为![]() 的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率
的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率![]() 随时间t变化的关系曲线
随时间t变化的关系曲线![]() 如图
如图![]() 请在图2中画出:在温度为
请在图2中画出:在温度为![]() ,Ru催化分解初始浓度为
,Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 随t变化的总趋势曲线
随t变化的总趋势曲线![]() 标注
标注![]() ______
______
③如果将反应温度提高到![]() ,请如图2中再添加一条Ru催化分解初始浓度为
,请如图2中再添加一条Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 的总趋势曲线
的总趋势曲线![]() 标注
标注![]() ______
______
④假设Ru催化下温度为![]() 时氨气分解的平衡转化率为
时氨气分解的平衡转化率为![]() ,则该温度下此分解反应的平衡常数K与
,则该温度下此分解反应的平衡常数K与![]() 的关系式是:
的关系式是:![]() ______ .
______ .
![]() 用Pt电极对液氨进行电解也可产生
用Pt电极对液氨进行电解也可产生![]() 和
和![]() 阴极的电极反应式是 ______ ;阳极的电极反应式是 ______
阴极的电极反应式是 ______ ;阳极的电极反应式是 ______ ![]() 已知:液氨中
已知:液氨中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.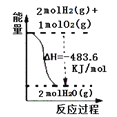 表示 H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
表示 H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.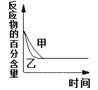 表示压强对可逆反应2A(g) + 2B(g)
表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C.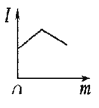 表示在一定温度下,向氢氧化钡溶液中滴入硫酸溶液至过量时,溶液的导电性即电流强度(I)随加入硫酸溶液的量(m)的变化曲线
表示在一定温度下,向氢氧化钡溶液中滴入硫酸溶液至过量时,溶液的导电性即电流强度(I)随加入硫酸溶液的量(m)的变化曲线
D.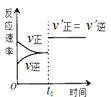 表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件可能是使用了催化剂
表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件可能是使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com