
【题目】下列图示与对应的叙述相符的是( )
A.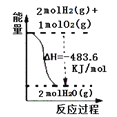 表示 H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
表示 H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.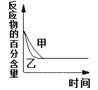 表示压强对可逆反应2A(g) + 2B(g)
表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C.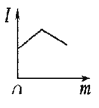 表示在一定温度下,向氢氧化钡溶液中滴入硫酸溶液至过量时,溶液的导电性即电流强度(I)随加入硫酸溶液的量(m)的变化曲线
表示在一定温度下,向氢氧化钡溶液中滴入硫酸溶液至过量时,溶液的导电性即电流强度(I)随加入硫酸溶液的量(m)的变化曲线
D.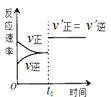 表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件可能是使用了催化剂
表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件可能是使用了催化剂
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】诺贝尔化学奖获得者乔治·欧拉教授率领团队首次采用金属钌作催化剂,从空气中捕获CO2直接转化为甲醇,为通往未来“甲醇经济”迈出了重要一步,并依据该原理开发如图所示转化。
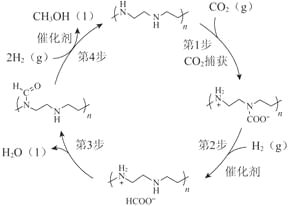
(1)CO2中含有的化学键类型是_________键。
(2)将生成的甲醇(沸点为64.7℃)与水分离可采取的方法是_________。
(3)上图所示转化中,由第1步至第4步的反应热(ΔH)依次是a kJ/mol、b kJ/mol、c kJ/mol、d kJ/mol,则该转化总反应的热化学方程式是_________。
(4)500℃时,利用金属钌做催化剂,在固定容积的密闭容器中可直接实现如(3)中转化得到甲醇。测得该反应体系中X、Y浓度随时间变化如图。
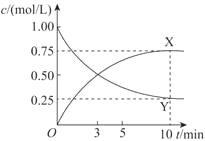
①Y的化学式是_________,判断的理由是_________。
②下列说法正确的是_________(选填字母)。
A.Y的转化率是75% |
B.其他条件不变时,若在恒压条件下进行该反应,Y的转化率高于75% |
C.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应 |
D.金属钌可大大提高该反应中反应物的转化率 |
③从反应开始到平衡,用氢气表示的平均反应速率v(H2) =_________mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池 | B. 锂离子电池放电 | C. 火箭的燃料燃烧 | D. 葡萄糖提供能量 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中,正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若将盐酸体积改为60 mL,理论上所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。

在410~440℃温度范围内,下列说法不正确的是
A. 温度一定时,随乙醇进料量增大,乙醇转化率减小
B. 温度一定时,随乙醇进料量增大,乙烯选择性增大
C. 乙醇进料量一定时,随温度的升高,乙烯选择性一定增大
D. 选择适当的催化剂在一定条件下,可大幅提高乙烯在最终产物中的比率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是

A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。

①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示,实验操作为:预先使棉花团浸透乙醇,并按照图装置好,在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
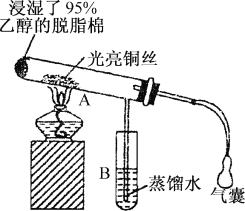
请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为:________。
(2)从A管中可观察到_______的实验现象,从中可认识到在该实验过程中,催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______。
(3)已知醇的氧化反应是放热反应,在实验进行一段时间后,如果只撤掉酒精灯,反应还能否继续进行?______;原受热的铜丝处有什么现象?_______。
(4)验证乙醇氧化产物的化学方法是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com