
����Ŀ����չ���⼼��������ȼ�ϵ���ƹ�Ӧ�õĹؼ����о�����Һ����һ�����õĴ������ʣ��䴢�������ɴ�![]()
![]() ��������
��������![]() Һ��������ֽ��������������Ϊȼ�Ϲ�������ȼ�ϵ�أ������ֽⷴӦ���Ȼ�ѧ����ʽ���£�
Һ��������ֽ��������������Ϊȼ�Ϲ�������ȼ�ϵ�أ������ֽⷴӦ���Ȼ�ѧ����ʽ���£�![]()
��ش��������⣺

![]() �����Է��ֽ�ķ�Ӧ������ ______ ��
�����Է��ֽ�ķ�Ӧ������ ______ ��
![]() ��֪��
��֪��![]()
![]()
![]()
![]()
��Ӧ![]()
![]() ��
��![]() ______ ��
______ ��
![]() �о��������������ɼ��ٰ����ķֽ⣮ͼ1Ϊij�¶��µ������IJ�ͬ�����ֱ����Ũ�Ȱ����ֽ����������ij�ʼ���ʣ�
�о��������������ɼ��ٰ����ķֽ⣮ͼ1Ϊij�¶��µ������IJ�ͬ�����ֱ����Ũ�Ȱ����ֽ����������ij�ʼ���ʣ�
�ٲ�ͬ���������£������ֽⷴӦ�Ļ�������� ______ ![]() ��д�����Ļ�ѧʽ
��д�����Ļ�ѧʽ![]() ��
��
�ں���![]() ����ʱ����Ni���ֽ��ʼŨ��Ϊ
����ʱ����Ni���ֽ��ʼŨ��Ϊ![]() �İ�������ʵʱ���ֽ�����а�����Ũ�ȣ������ð�����ת����
�İ�������ʵʱ���ֽ�����а�����Ũ�ȣ������ð�����ת����![]() ��ʱ��t�仯�Ĺ�ϵ����
��ʱ��t�仯�Ĺ�ϵ����![]() ��ͼ
��ͼ![]() ����ͼ2�л��������¶�Ϊ
����ͼ2�л��������¶�Ϊ![]() ��Ru���ֽ��ʼŨ��Ϊ
��Ru���ֽ��ʼŨ��Ϊ![]() �İ���������
�İ���������![]() ��t�仯������������
��t�仯������������![]() ��ע
��ע![]() ______
______
���������Ӧ�¶���ߵ�![]() ������ͼ2��������һ��Ru���ֽ��ʼŨ��Ϊ
������ͼ2��������һ��Ru���ֽ��ʼŨ��Ϊ![]() �İ���������
����������![]() ������������
������������![]() ��ע
��ע![]() ______
______
�ܼ���Ru�����¶�Ϊ![]() ʱ�����ֽ��ƽ��ת����Ϊ
ʱ�����ֽ��ƽ��ת����Ϊ![]() ������¶��´˷ֽⷴӦ��ƽ�ⳣ��K��
������¶��´˷ֽⷴӦ��ƽ�ⳣ��K��![]() �Ĺ�ϵʽ�ǣ�
�Ĺ�ϵʽ�ǣ�![]() ______ ��
______ ��
![]() ��Pt�缫��Һ�����е��Ҳ�ɲ���
��Pt�缫��Һ�����е��Ҳ�ɲ���![]() ��
��![]() �����ĵ缫��Ӧʽ�� ______ �������ĵ缫��Ӧʽ�� ______
�����ĵ缫��Ӧʽ�� ______ �������ĵ缫��Ӧʽ�� ______ ![]() ��֪��Һ����
��֪��Һ����![]()
���𰸡����� ![]() Fe
Fe 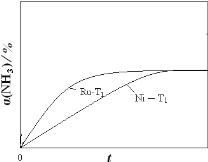
![]()
![]()
![]()
��������
![]() ��ѧ��Ӧ�ܷ��Է����У�ȡ�����ʱ���ر���ۺ��оݣ�
��ѧ��Ӧ�ܷ��Է����У�ȡ�����ʱ���ر���ۺ��оݣ�
![]() ���ݸ�˹���ɼ��㷴Ӧ�ȣ�
���ݸ�˹���ɼ��㷴Ӧ�ȣ�
![]() ��Ӧ�Ļ��Խ�ߣ���Ӧ�л������Խ�٣���Ӧ����Խ����
��Ӧ�Ļ��Խ�ߣ���Ӧ�л������Խ�٣���Ӧ����Խ����
![]() ���ֽ��ʼŨ��Ϊ
���ֽ��ʼŨ��Ϊ![]() �İ�����ƽ��ʱ
�İ�����ƽ��ʱ![]() ���䣬��Ӧ���ʼӿ죬����ƽ������ʱ���Ni��ʱҪ�̣�
���䣬��Ӧ���ʼӿ죬����ƽ������ʱ���Ni��ʱҪ�̣�
![]() ����Ӧ�¶���ߵ�
����Ӧ�¶���ߵ�![]() ����Ӧ���ʼӿ죬�����ķֽⷴӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
����Ӧ���ʼӿ죬�����ķֽⷴӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
![]() ��������Ե�ƽ��Ũ�ȣ�Ȼ�����ƽ�ⳣ���ĸ������ش�
��������Ե�ƽ��Ũ�ȣ�Ȼ�����ƽ�ⳣ���ĸ������ش�
![]() ���ʱ���������õ��ӵĻ�ԭ��Ӧ��Һ��ʧ��������������
���ʱ���������õ��ӵĻ�ԭ��Ӧ��Һ��ʧ��������������![]() ����������ʧȥ���ӵ�������Ӧ��
����������ʧȥ���ӵ�������Ӧ��
![]() ��֪��
��֪��![]() ����Ӧ����������ʵ���������
����Ӧ����������ʵ���������![]() ������
������![]() ����Ҫʹ
����Ҫʹ![]() �������ڽϸ��¶��£��ʴ�Ϊ�����£�
�������ڽϸ��¶��£��ʴ�Ϊ�����£�
![]() ��֪��
��֪��
![]()
![]()
![]()
�ɸ�˹���ɣ�![]() �õ���Ӧ
�õ���Ӧ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ��Ӧ�Ļ��Խ�ߣ���Ӧ�л������Խ�٣���Ӧ����Խ���������ķֽ����������ķ�Ӧ�У������ֽⷴӦ�Ļ�������Fe������ʱ�����ʴ�Ϊ��Fe��
��Ӧ�Ļ��Խ�ߣ���Ӧ�л������Խ�٣���Ӧ����Խ���������ķֽ����������ķ�Ӧ�У������ֽⷴӦ�Ļ�������Fe������ʱ�����ʴ�Ϊ��Fe��
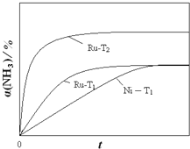
![]() ���ֽ��ʼŨ��Ϊ
���ֽ��ʼŨ��Ϊ![]() �İ�����ƽ��ʱ
�İ�����ƽ��ʱ![]() ���䣬��Ni��������ͬ�����Ƿ�Ӧ���ʼӿ죬����ƽ������ʱ���Ni��ʱҪ�̣���ͼ��Ϊ
���䣬��Ni��������ͬ�����Ƿ�Ӧ���ʼӿ죬����ƽ������ʱ���Ni��ʱҪ�̣���ͼ��Ϊ ��
��
![]() ����Ӧ�¶���ߵ�
����Ӧ�¶���ߵ�![]() ����Ӧ���ʼӿ죬����ƽ������ʱ�����̣������ķֽⷴӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���������ת����������
����Ӧ���ʼӿ죬����ƽ������ʱ�����̣������ķֽⷴӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���������ת����������![]() �¶�ʱRu���ֽ��ʼŨ��Ϊ
�¶�ʱRu���ֽ��ʼŨ��Ϊ![]() �İ���������
�İ���������![]() ������������Ϊ����������
������������Ϊ����������![]() ��ע
��ע![]() Ϊ
Ϊ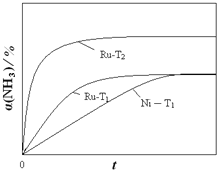 ��
��
![]() ƽ��ʱ������������������Ũ�ȷֱ���
ƽ��ʱ������������������Ũ�ȷֱ���![]() ��
��![]() ��
��![]() ����
����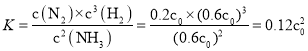 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ���ʱ���������õ��ӵĻ�ԭ��Ӧ��������Һ��ʧ��������������
���ʱ���������õ��ӵĻ�ԭ��Ӧ��������Һ��ʧ��������������![]() ����缫����ʽΪ��
����缫����ʽΪ��![]() ����������ʧȥ���ӵ�������Ӧ��������Һ���õ����ӣ��缫��ӦʽΪ��
����������ʧȥ���ӵ�������Ӧ��������Һ���õ����ӣ��缫��ӦʽΪ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������о�![]() ��
��![]() �ȴ�����Ⱦ������ƴ���������Ҫ���塣
�ȴ�����Ⱦ������ƴ���������Ҫ���塣
(1)![]() ���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�
���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�![]() ����֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
����֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��![]()
![]() ��
��
��![]()
![]() ��
��
��![]()
![]() ��
��
��Ӧ![]() ��
��![]() _____
_____![]()
(2)ȼú���糧�����÷�Ӧ![]()
![]() ��ú����������������
��ú����������������![]() ���ŷš����ڸ÷�Ӧ����
���ŷš����ڸ÷�Ӧ����![]() ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
��![]() �ڣ�ƽ����Ӧ����
�ڣ�ƽ����Ӧ����![]() ________
________![]() ���������¶ȣ��÷�Ӧ��ƽ�ⳣ��K________
���������¶ȣ��÷�Ӧ��ƽ�ⳣ��K________![]() ��������������С������������
��������������������������![]() ��
��
��![]() ��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⡣�����ϱ��е������жϣ��ı������������________
��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⡣�����ϱ��е������жϣ��ı������������________![]() ����ĸ
����ĸ![]() ��
��
A.����һ�����ķ�״̼���
B.ͨ��һ������![]()
C.�ʵ���С���������
D.������ʵĴ���
(3)![]() ���ŷ���Ҫ����������β�����������÷�Ӧ
���ŷ���Ҫ����������β�����������÷�Ӧ![]()
![]()
![]()
![]() ���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ�����NO��ת�������¶ȵı仯��ͼ��ʾ��
���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ�����NO��ת�������¶ȵı仯��ͼ��ʾ��
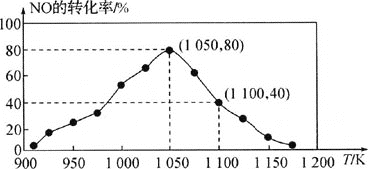
��ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����߶�������ԭ��Ϊ________����1100Kʱ��![]() ���������Ϊ________��
���������Ϊ________��
(4)��ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��![]() ����
����![]() ����1050K��
����1050K��![]() ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��
ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��![]() ________
________![]() ��֪�������ѹ
��֪�������ѹ![]() ������ѹ
������ѹ![]() �������
�������![]() ��
��
(5)Ϊ��������β���е��к�����Դ�������Ⱦ�����������װβ������װ�á��ھ���װ����CO��NO������Ӧ![]()
![]()
![]()
![]() ����������
����������![]() ��
��![]() ��ʵ���ã�
��ʵ���ã�![]() ��
��![]() ��
��![]() Ϊ���ʳ�����ֻ���¶��й�
Ϊ���ʳ�����ֻ���¶��й�![]() ��
��
�ٴﵽƽ��������¶ȣ�![]() ����ı���________
����ı���________![]() ����
����![]() ����
����![]() ������
������![]() ��
��![]() ����ı�����
����ı�����
������1L���ܱ������г���1molCO��1molNO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ![]() ����
����![]() __________��
__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ŵ������ѧ�������������ŷ�����������Ŷ��״β��ý��������������ӿ����в���CO2ֱ��ת��Ϊ�״���Ϊͨ��δ�����״���������������Ҫһ���������ݸ�ԭ��������ͼ��ʾת����
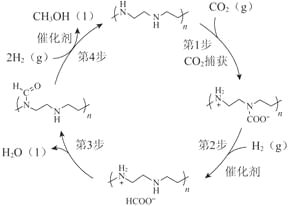
��1��CO2�к��еĻ�ѧ��������_________����
��2�������ɵļ״����е�Ϊ64.7�棩��ˮ����ɲ�ȡ�ķ�����_________��
��3����ͼ��ʾת���У��ɵ�1������4���ķ�Ӧ�ȣ���H��������a kJ/mol��b kJ/mol��c kJ/mol��d kJ/mol�����ת���ܷ�Ӧ���Ȼ�ѧ����ʽ��_________��
��4��500��ʱ�����ý��������������ڹ̶��ݻ����ܱ������п�ֱ��ʵ���磨3����ת���õ��״�����ø÷�Ӧ��ϵ��X��YŨ����ʱ��仯��ͼ��
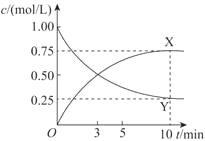
��Y�Ļ�ѧʽ��_________���жϵ�������_________��
������˵����ȷ����_________��ѡ����ĸ����
A��Y��ת������75% |
B��������������ʱ�����ں�ѹ�����½��и÷�Ӧ��Y��ת���ʸ���75% |
C�������¶�ʹ�÷�Ӧ��ƽ�ⳣ��K�������֪�÷�ӦΪ���ȷ�Ӧ |
D�������ɿɴ����߸÷�Ӧ�з�Ӧ���ת���� |
�۴ӷ�Ӧ��ʼ��ƽ�⣬��������ʾ��ƽ����Ӧ����v(H2) =_________mol/(L��min)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��11��Ũ�Ⱦ�Ϊ ![]() ��
��![]() ��
�� ![]() ����һ�������·�����Ӧ
����һ�������·�����Ӧ![]()
![]()
![]() �����
�����![]() ��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
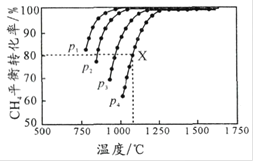
A.ƽ��ʱCO��![]() �����ʵ�����Ϊ
�����ʵ�����Ϊ![]()
B.![]() �ɴ�С��˳��Ϊ
�ɴ�С��˳��Ϊ ![]()
C.![]() �� p
�� p![]() �����£��÷�Ӧ
�����£��÷�Ӧ![]() ʱ�ﵽƽ���X����
ʱ�ﵽƽ���X���� ![]()
D.�����¶����ߣ��÷�Ӧ��ƽ�ⳣ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����ݻ�Ϊ2L���ܱ������У���2mol����M��3molN�����ϣ��������·�Ӧ��![]()
![]() ���÷�Ӧ��ƽ��ʱ������
���÷�Ӧ��ƽ��ʱ������![]() R�������Q��Ũ��Ϊ
R�������Q��Ũ��Ϊ![]() �������й�������ȷ����
�������й�������ȷ����![]()
A.xֵΪ2B.���������ܶ�����
C.ƽ��ʱN��Ũ��Ϊ![]()
![]() D.N��ת����Ϊ
D.N��ת����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH��10 �� X��Y ���ּ���Һ�� 1 mL���ֱ�ϡ���� 100 mL���� pH ����Һ�� ����V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A.�� 8��a��10���� X��Y ��������
B.X��Y ���ּ���Һ�����ʵ����ʵ���Ũ��һ�����
C.ϡ�ͺ�X ��Һ�ļ��Ա� Y ��Һ�ļ���ǿ
D.�ֱ���ȫ�к� X��Y �����ּ���Һʱ������ͬŨ���������� Vx��Vy
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת��������������ԭ��Ӧ�ص���
A. ��̫���ܵ�� | B. ����ӵ�طŵ� | C. �����ȼ��ȼ�� | D. �������ṩ���� |
|
|
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���տα�ʵ��Ҫ����50mL 0.50mol/L��������50mL 0.55mol/L��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų������������к��ȡ�����˵���У���ȷ����

A. ʵ�������û��������ʧ
B. ͼ��ʵ��װ��ȱ�ٻ��β��������
C. �ձ���������ֽ���������ǹ̶�С�ձ�
D. �������������Ϊ60 mL�������������к��Ȳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��һ�����۵�̼��Դ�����ۺ����þ�����Ҫ���塣
��һ��CO2�Ļ�ѧ����
��1��CO2���Ա�NaOH��Һ������������ҺpH=13��CO2��Ҫת��Ϊ___��д��̼���ӷ��ţ����������£�H2CO3��Ka1=4.3��10��7��Ka2=5.6��10��11��
��2��������������أ�SOEC�����ڸ��¹����CO/H2���ȿ�ʵ��CO2�ļ����ֿɸ�Ч�Ʊ��ϳ�����CO/H2�����乤��ԭ����ͼ��д���缫A�����ĵ缫��Ӧʽ___��

������CO2���ۺ�����
��1��CO2��CH4���������Ƶúϳ�����
��Ӧ��CH4��g��H+CO2��g��2CO��g��+2H2��g����H1
��֪������һ����̼�ͼ���ı�ȼ���ȣ�25�棩�����ʾ
���� | H2��g�� | CO��g�� | CH4��g�� |
��ȼ���ȡ�H/kJmol��1 | ��285.8 | ��283.0 | ��890.3 |
��ӦI�ġ�H=___kJmol��1��
��2����CO2��������ȡ�����ѵķ�ӦΪ����Ӧ��.2CO2��g��+6H2��g��CH3OCH3��g��+3H2O��g������10L�����ܱ������У�������2mol CO2��6moH2���ֱ���ҿ��Ir�����棨Ce������������Ӧ������ͬ��ʱ����õ�CO2��ת��������CO2���淴Ӧ�¶ȵı仯�����ͼ1��

�ٸ���ͼ1������˵������ȷ����___��
A����Ӧ��ġ�H��0����S��0
B����Ir��Ce������ʱ����Ӧ��Ļ�ܸ��͵���Ce
C��״̬dʱ��v��������v���棩
D����״̬b��d������CO2����������С����С��ԭ��������¶�����ƽ�������ƶ�
��״̬e��900K��ʱ������CO2��=50%�����ʱ��ƽ�ⳣ��K=___��
����H2��CO2�����ʵ���֮��Ϊn��1��900Kʱ��Ӧƽ����ϵ�ж����ѵ����ʵ�������Ϊx������ͼ2�л���x��n�仯��ʾ��ͼ��_______
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com