
【题目】CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
(1)若温度不变,加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同);若该溶液升高温度,下列表达式的数据增大的是________。
A c(H+)
B c(H+)c(OH-)
C 
D 
(2)某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁a、b胶头滴管的胶头,观察实验现象

①装置A、B中用红墨水而不用水的目的是________________。
②实验刚开始时,发现装置A中的长导管液面上升得比装置B中的要快。则胶头滴管a中盛的是__________。 两装置反应结束时(无固体剩余)。静置后两装置中的长导管或面均有所下降,最终液面高度__________(填“相等”。“A中的高”或“B中的高”).
(3)实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也是显著强于纯水。又知液态纯酸都能像水那样进行自身电离而建立平衡。且在一定温度下都有各自的离子积常数。据此回答:
①5°C时,液态纯硫酸的离子积常数K(H2SO4)_____1×10-14(填“>”“<”或“=”).
②在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________。
(4)在某温度下的水溶液中,c(H+)=10xmolL-1,c(OH-)=10ymolL-1,x与y的关系如图所示:

①该温度下,水的离子积为____________。
②该温度下,0.01 molL-1 NaOH溶液中水电离出c(OH-)为____________。
【答案】A ABCD 便于观察长导管中液面高度的变化; 盐酸 相同 > HSO4 1.0×10-15 1.0×10-13mol/L
【解析】
(1)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小;由于温度不变,则电离平衡常数、水的离子积不变;升高温度后醋酸的电离程度增大,则溶液中氢离子浓度增大、水的离子积增大、电离平衡常数增大;
(2)①装置A、B中用红墨水而不用水,便于观察长导管中液面高度的变化;
②实验刚开始时,盐酸溶液中的c(H+)大,与等质量的锌粒反应时单位时间内放出的热量多,产生的H2多,所以装置中压强大,长导管中液面上升快;两装置反应刚结束时(无固体剩余),发现装置A中的长导管液面比装置B中的高,静置一会后,温度下降压强减小,两装置中的长导管液面均有所下降,但二者产生的氢气的量相等,所以最终液面高度相同;
(3)①由于纯硫酸的导电性显著强于纯水,所以25℃时,液态纯硫酸的离子积常数K(H2SO4)>1×1014;
②由于纯硫酸的电离能力强于纯硝酸,则在纯硫酸和纯硝酸的液态混合酸中2H2SO4H3SO4++HSO4为主要的电离方式;
(4)①该温度下,溶液中水的离子积常数Kw=c(H+)·c(OH-),即Kw=10x×10y=10x+y;
②0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,H+全部由水电离得到,根据水的离子积常数计算氢离子浓度,再依据c水(OH-)=c水(H+)计算溶液中水电离出c(OH-)。
(1)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小;由于温度不变,则电离平衡常数、水的离子积不变;
A. 0.1 molL1的CH3COOH溶液加水稀释过程中,氢离子浓度减小,故A正确;
B. Kw=c(H+)c(OH)只受温度的影响,温度不变,则其值是一个常数,故B错误;
C. 由于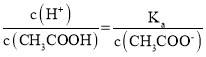 ,醋酸根离子浓度减小,温度不变,电离平衡常数不变,则
,醋酸根离子浓度减小,温度不变,电离平衡常数不变,则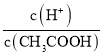 增大,故C错误;
增大,故C错误;
D. 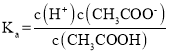 为醋酸的电离平衡常数,由于温度不变,则电离平衡常数不变,故D错误;
为醋酸的电离平衡常数,由于温度不变,则电离平衡常数不变,故D错误;
若该溶液升高温度,醋酸、水的电离程度均增大,则溶液中氢离子、醋酸根离子浓度都增大,醋酸分子的浓度减小,水的离子积增大、电离平衡常数增大;
A. 升高温度,促进醋酸的电离,溶液中氢离子浓度增大,故A正确;
B. Kw=c(H+)c(OH)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故B正确;
C. 升高温度,醋酸的电离程度增大,氢离子浓度增大,醋酸分子的浓度减小,则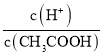 的比值增大,故C正确;
的比值增大,故C正确;
D. 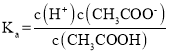 为醋酸的电离平衡常数,升高温度,电离平衡常数增大,故D正确;
为醋酸的电离平衡常数,升高温度,电离平衡常数增大,故D正确;
故答案为:A;ABCD;
(2)①装置A、B中用红墨水而不用水的原因是便于观察长导管中液面高度的变化;
故答案为:便于观察长导管中液面高度的变化;
②实验刚开始时,盐酸溶液中的c(H+)大,与等质量的锌粒反应时单位时间内放出的热量多,产生的H2多,所以装置中压强大,长导管中液面上升快,所以若发现装置A中的长导管液面上升的比装置B的要高,则胶头滴管a中盛的是盐酸;两装置反应刚结束时(无固体剩余),发现装置A中的长导管液面比装置B中的高,静置一会后,温度下降压强减小,两装置中的长导管液面均有所下降,但二者产生的氢气的量相等,所以最终液面高度相同;
故答案为:盐酸;相同;
(3)①根据实验表明,液态时,纯硫酸的导电性显著强于纯水,已知液态纯酸都能像水那样进行自身电离(H2O+H2OH3O++OH)而建立平衡,且在一定温度下都有各自的离子积常数,这些信息告诉我们纯硫酸存在着电离平衡,且电离程度强于纯水,仿照纯水的电离方式,可以推知纯硫酸的电离方程式为:2H2SO4H3SO4++HSO4,由于纯硫酸的导电性显著强于纯水,所以25℃时,液态纯硫酸的离子积常数K(H2SO4)>1×1014;
故答案为:>;
②由于纯硫酸的电离能力强于纯硝酸,则在纯硫酸和纯硝酸的液态混合酸中2H2SO4H3SO4++HSO4为主要的电离方式,而纯硝酸电离受到纯硫酸电离出的H+的抑制,因此在纯硫酸和纯硝酸的液态混合酸中,存在的阴离子主要是HSO4;
故答案为:HSO4;
(4)①该温度下,溶液中水的离子积常数Kw=c(H+)·c(OH-),即Kw=10x×10y=10x+y,由图象可知,x+y=-15,故Kw=1.0×10-15;
故答案为:1.0×10-15;
②该温度下,水的离子积常数为10-15,0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,H+全部由水电离得到,根据水的离子积常数得溶液中c水(H+)=c水(OH-)= ;
;
故答案为:1.0×10-13mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
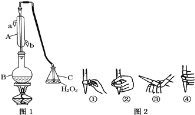
(1)仪器A的名称是 ______,水通入A的进口为 ______。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ______
(3)除去C中过量的H2O2,然后用0.090 0molL-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ______ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ______ ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) ______ (①=10mL;②=40mL;③<10mL;④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:______ gL-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;2NaCl+H2SO4![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;Na2SO4+4C![]() Na2S+4CO↑
Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;Na2S+CaCO3![]() Na2CO3+CaS
Na2CO3+CaS
下列说法正确的是( )
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中投入1 mol CO2和 2.75 mol H2发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量如图所示。下列说法正确的是

A. 该反应的正反应为吸热反应 B. 压强大小关系为p1<p2<p3
C. M点对应平衡常数K的值约为1.04×10-2 D. 在p2及512 K时,图中N点v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g) +3H2(g) CH3OH(l) +H2O(l) H= -130kJmol-1
2H2(g)+O2(g)=2H2O(l) H=-572kJmol-1
CH3OH(1)的燃烧热H=________kJmol-1。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) H>0,在不同温度下乙酸的生成速率变化如图所示。
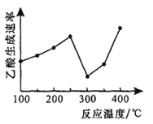
①当温度在250°C-300°C范围时,乙酸的生成速率减慢的主要原因是___________。
②欲使乙酸的平衡产率提高,应采取的措施是__________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应,2CO(g) C(s)+CO2(g).
①下列能说明该反应达到平衡的是______________。
A 容器内混合物的质量不变
B CO和CO2的物质的量之比不再变化
C 混合气体的平均摩尔质量不再变化
D 生成amo1CO2的同时消耗2amol.CO
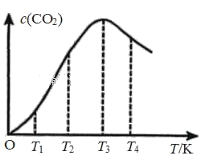
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c (CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T°C时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为________。在容积改变的条件下,反应速率可用单位时间内反应物成生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究![]() 、
、![]() 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。
(1)![]() 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的![]() 。已知吸收过程中相关反应的热化学方程式如下:
。已知吸收过程中相关反应的热化学方程式如下:
①![]()
![]() ;
;
②![]()
![]() ;
;
③![]()
![]() 。
。
则反应![]() 的
的![]() _____
_____![]()
(2)燃煤发电厂常利用反应![]()
![]() 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少![]() 的排放。对于该反应,在
的排放。对于该反应,在![]() 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①![]() 内,平均反应速率
内,平均反应速率![]() ________
________![]() ;当升高温度,该反应的平衡常数K________
;当升高温度,该反应的平衡常数K________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
②![]() 后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________
后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________![]() 填字母
填字母![]() 。
。
A.加入一定量的粉状碳酸钙
B.通入一定量的![]()
C.适当缩小容器的体积
D.加入合适的催化剂
(3)![]() 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应![]()
![]()
![]()
![]() ,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
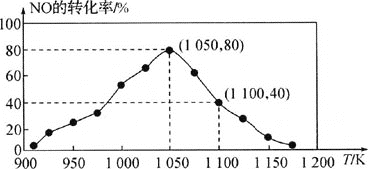
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;在1100K时,![]() 的体积分数为________。
的体积分数为________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数![]() 记作
记作![]() 。在1050K、
。在1050K、![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]() ________
________![]() 已知:气体分压
已知:气体分压![]() 气体总压
气体总压![]() 体积分数
体积分数![]() 。
。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应![]()
![]()
![]()
![]() ,生成无毒的
,生成无毒的![]() 和
和![]() 。实验测得,
。实验测得,![]() ,
,![]() 、
、![]() 为速率常数,只与温度有关
为速率常数,只与温度有关![]() 。
。
①达到平衡后,仅升高温度,![]() 增大的倍数________
增大的倍数________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 增大的倍数。
增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为![]() ,则
,则![]() __________。
__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上在一定条件下可利用反应I和II来制备:
(1)已知在25°C、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则表示燃烧热的热化学方程式为___
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L密闭容器中,CH4(g)+H2O(g)CO(g)+3H2(g)(I)CH4的转化率与温度、压强的关系如图所示:

①该反应的△H__0,△S__0(填“<”、“>”或“=”);
②已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为___,该反应的平衡常数为___(mol·L-1)2。
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___(填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大 D.再充入amolCO和3amolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1 mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为___________。
(2)B为0.1 mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入_____________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_______________。
(4)某酸H2B在水溶液中有如下变化:H2B![]() H++HB-;HB-
H++HB-;HB-![]() H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:_________________________
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是__________0.11 mol·L-1(填“<”,“>”,或“=”),理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3molN气体混合,发生如下反应:![]()
![]() ,该反应达平衡时,生成
,该反应达平衡时,生成![]() R,并测得Q的浓度为
R,并测得Q的浓度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是![]()
A.x值为2B.混合气体的密度增大
C.平衡时N的浓度为![]()
![]() D.N的转化率为
D.N的转化率为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com