
【题目】工业上用粗CuO制备CuCl2晶体的流程如下:
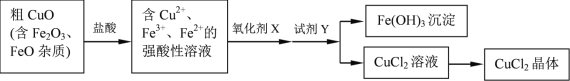
各种离子相关数据如下:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.0 | 4.7 | 1.9 |
完全转化成氢氧化物沉淀时的pH | 9.0 | 6.7 | 3.2 |
请回答:
(1)CuO溶于盐酸的离子方程式是_______________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
① NaClO溶液显_______性(填“酸”或“碱”)。你认为用NaClO作氧化剂X是否妥当__________(填“是”或“否”),理由是__________。
②下列另有几种常用的氧化剂,可用作氧化剂X的是__________。
a 浓H2SO4 b C12 c H2O2
(3)试剂Y的作用是调节溶液的pH=3.2,将Fe3+转化为Fe(OH)3沉淀,过滤后得到CuCl2溶液。下列试剂中适宜的是___________。
a NaOH b Na2CO3 c CuCO3 d CuO
(4)为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH____________。
【答案】CuO+2H+ = Cu2++H2O 碱 否 因NaClO溶液显碱性,会将Cu2+转化成沉淀,而且会引入杂质 bc cd 不能高于4.7
【解析】
粗CuO粉末(含有Fe2O3和FeO杂质)加入浓盐酸并加热得到含有Cu2+、Fe2+、Fe3+的混合溶液,通入氯气,可将氯化亚铁氧化生成氯化铁,然后加入CuO或CuCO3,调节溶液的pH,使Fe3+生成氢氧化铁沉淀,过滤除去氢氧化铁溶液,滤液为氯化铜溶液,应降温结晶、过滤得到氯化铜晶体,以此解答该题。
(1)CuO溶于盐酸生成CuCl2和水,发生反应的离子方程式是CuO+2H+ = Cu2++H2O;
(2)① NaClO是强碱弱酸盐,在NaClO溶液中ClO-水解,使溶液显碱性;因NaClO溶液显碱性,会将Cu2+转化成沉淀,而且会引入Na+及过量的ClO-,影响CuCl2晶体的纯度,故用NaClO作氧化剂X不妥当;
②选择氧化X时需要考虑氧化Fe2+生成Fe3+的同时不能引入新的杂质,结合最终产物为CuCl2,则不能选用浓硫酸,会引入SO42-,而应选择Cl2或H2O2,故答案为bc;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,同时不能引入新杂质,则可用CuO 或CuCO3,故答案为cd;
(4)Fe3+沉淀完全时pH=3.2,Cu2+开始沉淀时溶液pH=4.7,则为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH不能高于4.7。


科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1 mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为___________。
(2)B为0.1 mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入_____________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_______________。
(4)某酸H2B在水溶液中有如下变化:H2B![]() H++HB-;HB-
H++HB-;HB-![]() H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:_________________________
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是__________0.11 mol·L-1(填“<”,“>”,或“=”),理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3molN气体混合,发生如下反应:![]()
![]() ,该反应达平衡时,生成
,该反应达平衡时,生成![]() R,并测得Q的浓度为
R,并测得Q的浓度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是![]()
A.x值为2B.混合气体的密度增大
C.平衡时N的浓度为![]()
![]() D.N的转化率为
D.N的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池 | B. 锂离子电池放电 | C. 火箭的燃料燃烧 | D. 葡萄糖提供能量 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的单质、化合物在生产生活中有广泛应用。
(1)石墨是碳的一种单质。
已知:
C(石墨)+![]() O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
则C(石墨)+H2O(g)=CO(g)+H2(g)△H=___kJ·mol-1
②以石墨为电极电解饱和食盐水,阳极的电极反应式是___。
(2)利用CO2生产甲醇:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.0kJ·mol-l
往密闭容器中充入CO2和H2,在一定条件下反应,CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
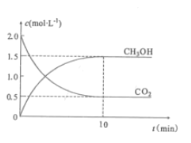
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol.L-1.min-1。
②达到平衡后,改变下列条件,能使化学平衡向正反应方向移动的是____(填标号)。
A.升高温度 B.再充入一定量的CO2 C.减小压强
(3)醋酸是常见的弱酸。
①往CH3COOH溶液中加入同体积、同浓度的氨水混合溶液的导电性___(填“增强”或“减弱“)。
②25℃时,往CH3COOH溶液中加入NaOH溶液,当c(CH3COO-)=(Na+)时,溶液pH___7(填“或“<")
(4)碳酸钠是一种重要碳酸盐。
①往0.1mol·L-1的Na2CO3溶液中滴入几滴酚酞试液,溶液呈现___色,原因是___(用离子方程式表示)。
②Na2CO3溶液可将锅炉水垢中的CaSO4转化为易除去的CaCO3:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(ag),25℃时该反应的平衡常数为___。[Ksp(CaCO3)=5.0×10-9,Ksp(CaSO4)=7.1×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中,正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若将盐酸体积改为60 mL,理论上所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是

A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是

A.该电池放电时的正极反应为2Li-2e-+CO32-===Li2CO2
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-===3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com