
【题目】![]() ,向5L恒容密闭容器中充入
,向5L恒容密闭容器中充入![]() 气体,发生反应
气体,发生反应![]() ,一段时间后达到平衡,测得此过程中从外界共吸收了
,一段时间后达到平衡,测得此过程中从外界共吸收了![]() 的热量.当温度度不变时,改变某一条件,下列结论正确的是
的热量.当温度度不变时,改变某一条件,下列结论正确的是![]()
条件改变 | 结论 | |
A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
B | 起始时向容器中充入 | 反应达到平衡前 |
C | 起始时向容器中充入 | 达到平衡时共放出 |
D | 起始时向容器中充入 | 达到平衡时, |
A.AB.BC.CD.D
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知:在![]() 时,
时,![]()
![]()
![]()
![]()
![]() 、
、![]() 、
、![]()
又已知:![]() ,下列说法正确的是
,下列说法正确的是![]()
A.醋酸钠水解的平衡常数![]() 随温度升高而减小
随温度升高而减小
B.![]() 醋酸钠溶液pH为m,其水解的程度
醋酸钠溶液pH为m,其水解的程度![]() 已水解的醋酸钠与原有醋酸钠的比值
已水解的醋酸钠与原有醋酸钠的比值![]() 为a;
为a;![]() 醋酸钠溶液pH为n,水解的程度为b,则
醋酸钠溶液pH为n,水解的程度为b,则![]() 、
、![]()
C.醋酸钠的水解的平衡常数![]()
D.在某溶液中含![]() 、
、![]() 、
、![]() 三种离子的浓度均为
三种离子的浓度均为![]() ,向其中加入固体醋酸钠,使其浓度为
,向其中加入固体醋酸钠,使其浓度为![]() ,以上三种金属离子中只有
,以上三种金属离子中只有![]() 能生成沉淀
能生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g) +3H2(g) CH3OH(l) +H2O(l) H= -130kJmol-1
2H2(g)+O2(g)=2H2O(l) H=-572kJmol-1
CH3OH(1)的燃烧热H=________kJmol-1。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) H>0,在不同温度下乙酸的生成速率变化如图所示。
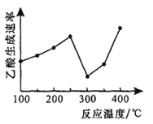
①当温度在250°C-300°C范围时,乙酸的生成速率减慢的主要原因是___________。
②欲使乙酸的平衡产率提高,应采取的措施是__________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应,2CO(g) C(s)+CO2(g).
①下列能说明该反应达到平衡的是______________。
A 容器内混合物的质量不变
B CO和CO2的物质的量之比不再变化
C 混合气体的平均摩尔质量不再变化
D 生成amo1CO2的同时消耗2amol.CO
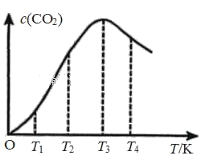
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c (CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T°C时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为________。在容积改变的条件下,反应速率可用单位时间内反应物成生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上在一定条件下可利用反应I和II来制备:
(1)已知在25°C、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则表示燃烧热的热化学方程式为___
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L密闭容器中,CH4(g)+H2O(g)CO(g)+3H2(g)(I)CH4的转化率与温度、压强的关系如图所示:

①该反应的△H__0,△S__0(填“<”、“>”或“=”);
②已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为___,该反应的平衡常数为___(mol·L-1)2。
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___(填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大 D.再充入amolCO和3amolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.向氨水中不断通入![]() ,随着
,随着![]() 的增加,
的增加, 不断增大
不断增大
B.在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C.常温下,反应![]() ,
,![]()
D.将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1 mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为___________。
(2)B为0.1 mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入_____________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_______________。
(4)某酸H2B在水溶液中有如下变化:H2B![]() H++HB-;HB-
H++HB-;HB-![]() H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:_________________________
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是__________0.11 mol·L-1(填“<”,“>”,或“=”),理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应![]() ,达平衡后,温度一定时,将气体体积缩小到原来的
,达平衡后,温度一定时,将气体体积缩小到原来的![]() ,当达新平衡时,C的浓度为原来的
,当达新平衡时,C的浓度为原来的![]() 倍,则下列推断正确的是
倍,则下列推断正确的是![]()
A.平衡向正向移动了
B.![]()
C.达新平衡时,A的浓度小于原平衡A浓度的2倍
D.达新平衡时,容器内总压一定比原平衡的2倍小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个固定容积均为1L密闭容器中以不同的氢碳比![]() 充入
充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]() 的平衡转化率
的平衡转化率![]() 与温度的关系如图所示.下列说法正确的是
与温度的关系如图所示.下列说法正确的是![]()
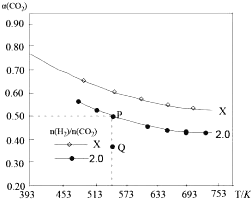
A.该反应在高温下自发进行
B.X的氢碳比![]() ,且Q点在氢碳比为
,且Q点在氢碳比为![]() 时
时![]()
C.若起始时,![]() 、
、![]() 浓度分别为
浓度分别为![]() 和
和![]() ,则可得到P点,对应温度的平衡常数的值为512
,则可得到P点,对应温度的平衡常数的值为512
D.向处于P点状态的容器中,按2:4:1:4的比例再充入![]() 、
、![]() 、
、![]() 、
、![]() ,再次平衡后
,再次平衡后![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的单质、化合物在生产生活中有广泛应用。
(1)石墨是碳的一种单质。
已知:
C(石墨)+![]() O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
则C(石墨)+H2O(g)=CO(g)+H2(g)△H=___kJ·mol-1
②以石墨为电极电解饱和食盐水,阳极的电极反应式是___。
(2)利用CO2生产甲醇:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.0kJ·mol-l
往密闭容器中充入CO2和H2,在一定条件下反应,CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
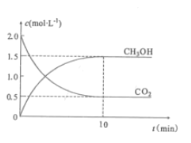
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol.L-1.min-1。
②达到平衡后,改变下列条件,能使化学平衡向正反应方向移动的是____(填标号)。
A.升高温度 B.再充入一定量的CO2 C.减小压强
(3)醋酸是常见的弱酸。
①往CH3COOH溶液中加入同体积、同浓度的氨水混合溶液的导电性___(填“增强”或“减弱“)。
②25℃时,往CH3COOH溶液中加入NaOH溶液,当c(CH3COO-)=(Na+)时,溶液pH___7(填“或“<")
(4)碳酸钠是一种重要碳酸盐。
①往0.1mol·L-1的Na2CO3溶液中滴入几滴酚酞试液,溶液呈现___色,原因是___(用离子方程式表示)。
②Na2CO3溶液可将锅炉水垢中的CaSO4转化为易除去的CaCO3:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(ag),25℃时该反应的平衡常数为___。[Ksp(CaCO3)=5.0×10-9,Ksp(CaSO4)=7.1×10-5]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com