
【题目】下列说法正确的是![]()
A.向氨水中不断通入![]() ,随着
,随着![]() 的增加,
的增加, 不断增大
不断增大
B.在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C.常温下,反应![]() ,
,![]()
D.将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深
科目:高中化学 来源: 题型:
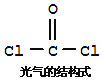
【题目】氯仿![]() 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气![]() :
:![]() ,下列说法不正确的有
,下列说法不正确的有![]()
![]()
A. ![]() 分子为含极性键的非极性分子
分子为含极性键的非极性分子
B. ![]() 分子中含有3个
分子中含有3个![]() 键、一个
键、一个![]() 键,中心C原子采用
键,中心C原子采用![]() 杂化
杂化
C. ![]() 分子中所有原子的最外层电子都满足8电子稳定结构
分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的叙述中正确的是( )
A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子
B.在28g晶体硅中,含Si﹣Si共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C﹣C键键能小于Si﹣Si键
D.镁型和铜型金属晶体的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应:
![]() +
+![]()
![]()
![]() +H2O
+H2O
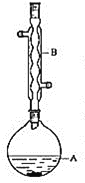
装置示意图为:
有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入![]() 异戊醇
异戊醇![]() 、数滴浓硫酸和
、数滴浓硫酸和![]() 片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水
片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集
固体,进行蒸馏纯化,收集![]() 馏分,得乙酸异戊脂
馏分,得乙酸异戊脂![]()
回答下列问题:
(1)仪器B的名称是_________
(2)在洗涤操作中,第一次水洗的主要目的是_____。第二次水洗的主要目的是_____
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)_______
a、直接将乙酸异戊脂从分液漏斗的上口倒出
b、直接将乙酸异戊从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊脂从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酚从上口倒出
(4)本实验中加入过量乙酸的目的是_____________
(5)实验中加入少量无水![]() 的目的是____________
的目的是____________
(6)在蒸馏操作中,仪器选择及安装都正确的是_________![]() 填标号
填标号![]() 。
。
a. 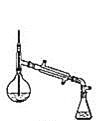 b.
b. 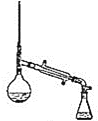 c.
c.  d.
d. 
(7)本实验的产率是________![]() 填标号
填标号![]()
![]() .
.![]() .
.![]()
(8)在进行蒸馏操作时:若从![]() 便开始收集馏分,会使实验的产率偏_________
便开始收集馏分,会使实验的产率偏_________![]() 填“高”或“低”
填“高”或“低”![]() ,其原因是___________
,其原因是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、如图所示,X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。

(1)甲池是___(填“原电池”或“电解池”,下同]装置;乙池是___装置。
(2)D极为___(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_______(填“a”或“b”);C极上的电极反应式为____。
(4)F极上的电极反应式为:____。
(5)当电路中通过0.02mol电子时,B电极上沉积0.64g金属X,则X为___(填元素符号),甲池中反应的化学方程式为___。
II、(1)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的数目为____;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是___。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图1。其原因是___。

③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:___,CuCl+FeCl3=CuCl2+FeCl2。
(2)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图2。转化时正极的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,向5L恒容密闭容器中充入
,向5L恒容密闭容器中充入![]() 气体,发生反应
气体,发生反应![]() ,一段时间后达到平衡,测得此过程中从外界共吸收了
,一段时间后达到平衡,测得此过程中从外界共吸收了![]() 的热量.当温度度不变时,改变某一条件,下列结论正确的是
的热量.当温度度不变时,改变某一条件,下列结论正确的是![]()
条件改变 | 结论 | |
A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
B | 起始时向容器中充入 | 反应达到平衡前 |
C | 起始时向容器中充入 | 达到平衡时共放出 |
D | 起始时向容器中充入 | 达到平衡时, |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。 利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
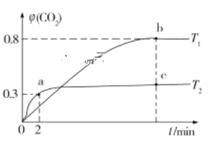
(1)温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=__________________。
(2)b点时CO的转化率为__________,化学反应的平衡常数K=_______(填表达式)。
(3)反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
(4)上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左”“向右”或“不”)移动。
(5)下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化
B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化
D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于特制的密优真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡NH2COONH4(s) ![]() 2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO2)=2:1,则再次达到平衡时c (NH3)( )
2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO2)=2:1,则再次达到平衡时c (NH3)( )
A.增大B.不变C.变小D.因条件不足无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com