
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。 利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
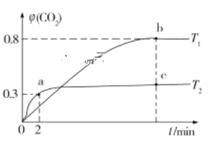
(1)温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=__________________。
(2)b点时CO的转化率为__________,化学反应的平衡常数K=_______(填表达式)。
(3)反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
(4)上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左”“向右”或“不”)移动。
(5)下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化
B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化
D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
【答案】0.15 mol·L 1·min 1 80% ![]() < 向右 BC
< 向右 BC
【解析】
(1)2 min时,CO2的体积分数为0.3,再根据v=![]() 计算速率;
计算速率;
(2)b点CO2的体积分数为0.8,利用三段法进行计算;
(3)根据先拐先平衡数据大可知,温度T2>T1,升高温度,CO2的体积分数减小,平衡逆向进行;
(4)根据浓度商与平衡常数之间的关系判断平衡是否发生和移动的方向;
(5)根据平衡移动的影响因素进行分析判断。
(1)2 min时,CO2的体积分数为0.3,根据三段法有
I2O5(s) + 5CO(g) ![]() 5CO2(g) + I2(s)
5CO2(g) + I2(s)
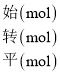
![]()
![]()
根据CO2的体积分数为0.3可知![]() ,解得x=0.6mol,因此v=
,解得x=0.6mol,因此v=![]() =
= =0.15mol/(Lmin);
=0.15mol/(Lmin);
(2)温度为T1时,CO2的体积分数为0.8,根据三段法有
I2O5(s) + 5CO(g) ![]() 5CO2(g) + I2(s)
5CO2(g) + I2(s)
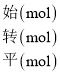
![]()
![]()
根据CO2的体积分数为0.8可知![]() ,解得y=1.6mol,CO2的转化率为
,解得y=1.6mol,CO2的转化率为![]() ×100%=80%;
×100%=80%;
平衡常数K=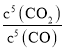 ;
;
(3)由分析知升高温度平衡逆向进行,而升高温度平衡向着吸热的方向移动,因此该反应正向为放热反应,即ΔH<0;
(4)T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则:
I2O5(s) + 5CO(g) ![]() 5CO2(g) + I2(s)
5CO2(g) + I2(s)
平衡量(mol) 0.4 1.6
0.4+2 1.6+2
因此浓度商Qc=![]() =7.59 K=
=7.59 K=![]() =1024
=1024
Qc<K,因此平衡正向移动,即向右移动;
(5)A.该反应为等体积反应,压强不变不能证明达到平衡状态,A项错误;
B. 该反应气体质量及物质的量均发生变化,混合气体的平均相对分子质量不再变化,证明反应达到了平衡状态,B项正确;
C. 气体的质量发生变化,体积不变,当混合气的密度不再变化时,说明反应达到了平衡状态,C项正确;
D. 单位时间内消耗CO和生成CO2的物质的量之比为1∶1,不能证明正反应速率等于逆反应速率,不能证明反应达到平衡状态,D项错误;
答案选BC。
Q<K | 反应向正反应方向进行,v正>v逆 |
Q=K | 反应处于化学平衡状态,v正=v逆 |
Q>K | 反应向逆反应方向进行,v正<v逆 |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
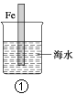
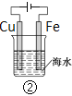
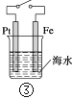
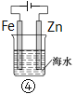
A.图①中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图②和④的装置中Fe电极均被保护
C.图③中,开关闭合时,Fe的腐蚀速率减小
D.在③开关闭合的情况下,四个装置中的Fe腐蚀速率由快到慢的顺序是:④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.向氨水中不断通入![]() ,随着
,随着![]() 的增加,
的增加, 不断增大
不断增大
B.在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C.常温下,反应![]() ,
,![]()
D.将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列叙述正确的是
A.将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8
B.用pH=1的盐酸分别中和1mL pH=13的NaOH溶液和氨水,NaOH消耗盐酸的体积大
C.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-)
D.室温下,向0.20 mol/L NH4HCO3中通入CO2至溶液呈中性:c(NH4+)=c(HCO3—)+2c(CO32—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应![]() ,达平衡后,温度一定时,将气体体积缩小到原来的
,达平衡后,温度一定时,将气体体积缩小到原来的![]() ,当达新平衡时,C的浓度为原来的
,当达新平衡时,C的浓度为原来的![]() 倍,则下列推断正确的是
倍,则下列推断正确的是![]()
A.平衡向正向移动了
B.![]()
C.达新平衡时,A的浓度小于原平衡A浓度的2倍
D.达新平衡时,容器内总压一定比原平衡的2倍小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. Cl2溶于水得到的氯水能导电,但Cl2不是电解质,而是非电解质
B. 以铁作阳极,铂作阴极,电解饱和食盐水,可以制备烧碱
C. 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为![]()
D. 反应Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g)室温下不能自发进行,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com