
【题目】下列说法正确的是( )
A. Cl2溶于水得到的氯水能导电,但Cl2不是电解质,而是非电解质
B. 以铁作阳极,铂作阴极,电解饱和食盐水,可以制备烧碱
C. 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为![]()
D. 反应Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g)室温下不能自发进行,则![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧的热化学方程式为_______________。
(2)甲醇蒸气转化为氢气的一种原理是CH3OH和H2O反应生成CO2和H2。下图是该过程中能量变化示意图。
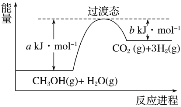
若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是________(填“增大”、“减小”或“不变”),反应热ΔH的变化是________(填“增大”、“减小”或“不变”)。请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、如图所示,X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。

(1)甲池是___(填“原电池”或“电解池”,下同]装置;乙池是___装置。
(2)D极为___(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_______(填“a”或“b”);C极上的电极反应式为____。
(4)F极上的电极反应式为:____。
(5)当电路中通过0.02mol电子时,B电极上沉积0.64g金属X,则X为___(填元素符号),甲池中反应的化学方程式为___。
II、(1)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的数目为____;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是___。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图1。其原因是___。

③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:___,CuCl+FeCl3=CuCl2+FeCl2。
(2)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图2。转化时正极的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。 利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
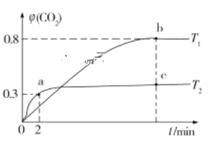
(1)温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=__________________。
(2)b点时CO的转化率为__________,化学反应的平衡常数K=_______(填表达式)。
(3)反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
(4)上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左”“向右”或“不”)移动。
(5)下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化
B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化
D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋为第五周期VA族元素,利用湿法冶金从辉铋矿(含Bi2S3、Bi、Bi2O3等)提取金属铋的工艺流程如下图所示:
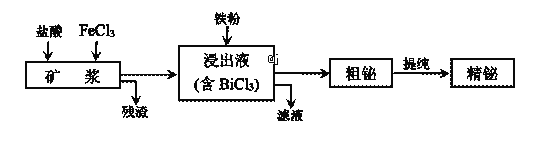
已知:BiCl3水解的离子方程式为:BiCl3+H2O![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
(1)矿浆浸出时加入盐酸的作用是______________。
(2)浸出时,Bi溶于FeCl3溶液的化学方程式为________________。
(3)残渣中含有一种单质,该单质是_______________。
(4)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,银元素以___________(填化学式)进入残渣中。
(5)粗铋提纯时,阴极的电极反应式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于特制的密优真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡NH2COONH4(s) ![]() 2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO2)=2:1,则再次达到平衡时c (NH3)( )
2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO2)=2:1,则再次达到平衡时c (NH3)( )
A.增大B.不变C.变小D.因条件不足无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。请回答:
(1)已知一定条件下发生如下反应:CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0--20h内该反应速率v(H2O)=_______。

③根据图1判断,催化剂的催化效果:M________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为__________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在室温时纯水中存在电离平衡:H2O![]() H++OH-。下列叙述正确的是( )
H++OH-。下列叙述正确的是( )
A. 向水中加入少量NH4Cl,由水电离出的c(H+)>1×10-7mol/L
B. 升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性
C. 向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低
D. 向水中加入少量硫酸,c(H+)增大,所以由水电离出的c(H+)>1×10-7mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com