
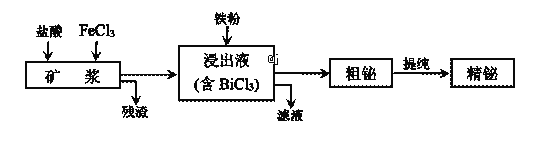
����Ŀ����Ϊ��������VA��Ԫ�أ�����ʪ��ұ��ӻ����(��Bi2S3��Bi��Bi2O3��)��ȡ������Ĺ�����������ͼ��ʾ��
��֪��BiCl3ˮ������ӷ���ʽΪ��BiCl3+H2O![]() BiOCl+2H++2Cl����
BiOCl+2H++2Cl����
��1������ʱ���������������______________��
��2������ʱ��Bi����FeCl3��Һ�Ļ�ѧ����ʽΪ________________��
��3�������к���һ�ֵ��ʣ��õ�����_______________��
��4����������к���Ag2S���������ܽ��������Һ����Ԫ����___________(�ѧʽ)��������С�
��5�������ᴿʱ�������ĵ缫��Ӧʽ��____________��
���𰸡�����![]() ˮ��
ˮ�� ![]()
![]()
![]()
![]()
��������
�����(��![]() ��
��![]() ��
��![]() ��)�Ʊ�
��)�Ʊ�![]() �����������������ܽ�ȡ�������Ȼ�����Һ�������������ɵ������˵õ�����Ϊ���ʣ���Һ�м���Fe��ԭ�����ӹ��˵õ����飬���ᴿ�ɵõ����飬�Դ˽����⡣
�����������������ܽ�ȡ�������Ȼ�����Һ�������������ɵ������˵õ�����Ϊ���ʣ���Һ�м���Fe��ԭ�����ӹ��˵õ����飬���ᴿ�ɵõ����飬�Դ˽����⡣
(1)![]() ����Ũ����,�����ӡ�����������ˮ��,����Ũ������ܽ�
����Ũ����,�����ӡ�����������ˮ��,����Ũ������ܽ�![]() ,ͬʱ��ֹ
,ͬʱ��ֹ![]() ��
��![]() ˮ�����ɲ����Գ������Ӷ����ԭ�ϵĽ����ʡ�
ˮ�����ɲ����Գ������Ӷ����ԭ�ϵĽ����ʡ�
�ʴ�Ϊ������![]() ˮ�⣻
ˮ�⣻
(2)����ʱ,![]() ����
����![]() ��Һ�Ļ�ѧ����ʽΪ
��Һ�Ļ�ѧ����ʽΪ![]() ��
��
�ʴ�Ϊ:![]() ��
��
(3)�����Ȼ�����Һ�������������ɵ������˵õ�����Ϊ���ʣ��ʴ�Ϊ��S��
(4)������Һ�д������������ӣ����Իᷢ����Ӧ��![]() ��Ԫ����
��Ԫ����![]() ��ʽ���������
��ʽ���������
�ʴ�Ϊ��![]() ;
;
(5)�����ᴿʱ,��![]() Ϊ����,������Ӧ��
Ϊ����,������Ӧ��![]() ��������
��������![]() ������Ӧ��
������Ӧ��![]() ��
��
�ʴ�Ϊ: ![]() ��
��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�ɷ���![]() ����
����![]() ��
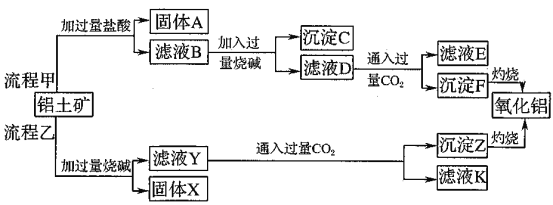
��![]() ��MgO�����ʣ�����ȡ���ֹ���Ʒ���������£�
��MgO�����ʣ�����ȡ���ֹ���Ʒ���������£�
��ش��������⣺
��1�����̼������������Al3+�ķ���ʽΪ_________.
��2�������Ҽ����ռ������SiO32-�����ӷ���ʽΪ________.
��3����֤��ҺB��![]() ����ȡ������Һ������________�����Լ����ƣ���
����ȡ������Һ������________�����Լ����ƣ���
��4����ҺE��K�����ʵ���Ҫ�ɷ���________(�ѧʽ)��д������Һ��һ����;________
��5����֪298Kʱ��![]() ���ݶȻ�����
���ݶȻ�����![]() =5.6��
=5.6��![]() ,ȡ��������ҺB,����һ�������ռ�ﵽ������Һƽ�⣬���PH=13.00������¶��²�������Һ�е�
,ȡ��������ҺB,����һ�������ռ�ﵽ������Һƽ�⣬���PH=13.00������¶��²�������Һ�е�![]() =_______.
=_______.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ�������оݵ�˵�����������ǣ� ��
A.1molH2O�ڲ�ͬ״̬ʱ����ֵ��S[H2O��s��]��S[H2O��g��]
B.�Է����еķ�Ӧһ����Ѹ�ٽ���
C.CaCO3��s��![]() CaO��s��+CO2��g����H��0�ܷ��Է��������¶��й�
CaO��s��+CO2��g����H��0�ܷ��Է��������¶��й�
D.�����£���ӦC��s��+CO2��g��=2CO��g�������Է����У���÷�Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������£�����������ȷ����
A.��1mL1.0��10-5mol/L����ϡ�͵�1000mL����Һ��pH=8
B.��pH=1������ֱ��к�1mL pH=13��NaOH��Һ�Ͱ�ˮ��NaOH��������������
C.pH=2��������pH=1������Ƚϣ�c(Cl-)=c(SO42-)
D.�����£���0.20 mol/L NH4HCO3��ͨ��CO2����Һ�����ԣ�c(NH4��)=c(HCO3��)+2c(CO32��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.200 0 mol��L��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£�
��������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
�ڹ̶��õζ��ܲ�ʹ�ζ��ܼ��촦����Һ�壻
�۵���Һ������0������0���̶������£������¶�����
����ȡ20.00 mL����Һע��ྻ�Ļ�������������ˮ����ƿ�У�������3�η�̪��Һ�� ���ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش��������⣺
��1�����ϲ����д������______(����)�����ⶨ���ƫ�ߣ���ԭ�������________(����ĸ)��
A.���Ʊ���Һ�Ĺ���NaOH�л���KOH���� B.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ C.ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ D.����ı�NaOH��Һ���ʵ���Ũ��ƫ��
��2���жϵζ��յ��������_____________________________________��
��3����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ________mL��

��4�������������ݣ��������������Ũ�ȣ�________mol��L��1��
�ζ����� | �������(mL) | ���ռ���Һ���(mL) | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 20.00 | 0.40 | 20.40 |
�ڶ��� | 20.00 | 2.00 | 24.10 |
������ | 20.00 | 4.00 | 24.00 |
��5����ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء�����H2(g)��CO(g)��CH3OH(l)��ȼ������H�ֱ�Ϊ��285.8 kJ��mol��1����283.0 kJ��mol��1�ͣ�726.5 kJ��mol��1����ش��������⣺
����̫���ֽܷ�10 molˮ���ĵ�������________kJ��
��CH3OH(l)����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. Cl2����ˮ�õ�����ˮ�ܵ��磬��Cl2���ǵ���ʣ����Ƿǵ����
B. ������������������������ⱥ��ʳ��ˮ�������Ʊ��ռ�
C. ��1mol Cl2ͨ��ˮ�У�HClO��Cl-��ClO-������֮��Ϊ![]()
D. ��ӦAl2O3(s)+3Cl2(g)+3C(s)�T2AlCl3(g)+3CO(g)�����²����Է����У���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������г���CO��![]() ��
��![]() mol��һ���¶��·�����Ӧ��
mol��һ���¶��·�����Ӧ��![]() ������������ȷ����
������������ȷ����
A.���������ѹǿ���ٸı䣬��֤���÷�Ӧ�Ѵﵽƽ��״̬
B.Ѱ�Һ��ʵĴ����Ǽӿ췴Ӧ���ʲ����![]() ���ʵ���Ч��ʩ
���ʵ���Ч��ʩ
C.����Ӧ�ﵽƽ�����������������䣬�������г���CO��![]() ��1mol���ﵽ�µ�ƽ���
��1mol���ﵽ�µ�ƽ���![]() �IJ��ʻ�����
�IJ��ʻ�����
D.�����ij�¶���ƽ�ⳣ��Ϊ![]() ����ƽ��ʱCOת����Ϊ
����ƽ��ʱCOת����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO�ϳɼ״�(CH3OH)�Ļ�ѧ����ʽΪCO(g)+2H2(g)CH3OH(g) ��H<0��������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
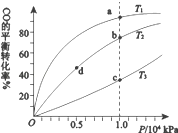
A.�¶ȣ�T1>T2>T3
B.����Ӧ���ʣ�v(b)>v(d) v(a)>v(c)
C.ƽ�ⳣ����K(a)>K(c) K(b)=K(d)
D.ƽ��Ħ��������M(b)>M(d) M(a)<M(c)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£����ݻ�Ϊ2L���ܱ������ڼ���0.4mol��N2��1.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��2NH3��g������Ӧ��NH3���ʵ����仯�����ͼ������˵������������
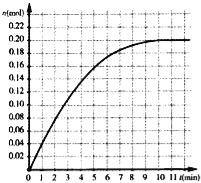
A.�����������䣬������5L�����ﵽƽ����Ҫ��ʱ�佫����10min
B.N2ƽ��ת����Ϊ25%
C.ƽ��ʱ������ѹǿΪ��ʼʱ��90%
D.��Ӧǰ10min��Ӧ����v��H2��=0.01molL��1min��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com