
【题目】如图图示与对应的叙述相符的是![]()
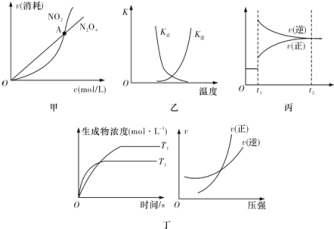
A.图甲表示在恒容密闭容器中,恒温条件下发生的可逆反应![]() ,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.图乙曲线表示反应![]() ,正、逆反应的平衡常数K随温度的变化
,正、逆反应的平衡常数K随温度的变化
C.图丙表示对反应![]() 在
在![]() 时刻增大压强
时刻增大压强
D.图丁表示反应![]() :
:![]() ;
;![]() ;
;![]()
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示。下列说法正确的是( )
的数据如图所示。下列说法正确的是( )
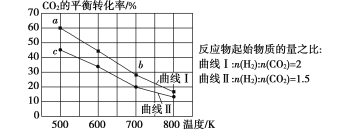
A.该反应的![]()
B.达到平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为90%
的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列8种物质:①Na2CO3 ②NaHCO3 ③NH4Cl ④酒精 ⑤CO2 ⑥Al ⑦食盐水 ⑧H2C2O4(草酸)
(1)上述物质中属于强电解质的是_________________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是________________(填序号)。
(2)上述③的水溶液呈酸性的原因是(用离子方程式表示)_________________。
(3)请写出⑧使KMnO4酸性溶液褪色的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·min)B.v(D)=1mol/(L·min)
C.v(C)=0.8mol/(L·min)D.v(B)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中的氮氧化物![]() 、
、![]() 、
、![]() 等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
![]() 汽车发动机工作时会引发反应:
汽车发动机工作时会引发反应:![]() ,
,![]() ,其能量变化示意图如下:
,其能量变化示意图如下:

则NO中氮氧键的键能为______![]() 。
。
![]() 以碱液为电解质可实现如下转化:
以碱液为电解质可实现如下转化:![]()
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
![]() 将
将![]() 和
和![]() 溶于水可得到相应的酸
溶于水可得到相应的酸![]() 时,两种酸的电离平衡常数如表:
时,两种酸的电离平衡常数如表:
|
| |
|
|
|
|
|
|
①![]() 的水解平衡常数为______。
的水解平衡常数为______。
②![]() 溶液和
溶液和![]() 溶液反应的离子方程式为______。
溶液反应的离子方程式为______。
![]() 汽车尾气处理催化装置中涉及的反应之一为:
汽车尾气处理催化装置中涉及的反应之一为:![]() ,
,![]() 研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验 编号 |
| NO初始浓度 | CO初始浓度 | 催化剂比表面积 |
Ⅰ | 400 |
|
| 82 |
Ⅱ | 400 |
|
| 124 |
Ⅲ | 450 |
|
| 124 |
根据下列坐标图,计算前5s内用![]() 表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势
表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势![]() 标明各条曲线的实验编号
标明各条曲线的实验编号![]() 。______
。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国采用长征三号甲运载火箭成功发射了 “嫦娥一号” 卫星。肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) △H =+8.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是 ( )
A.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H=–1059.3 kJ/mo
B.N2H4(g) + ![]() N2O4(g) =
N2O4(g) =![]() N2(g) + 2H2O(g) △H=–542.7 kJ/mol
N2(g) + 2H2O(g) △H=–542.7 kJ/mol
C.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–542.7 kJ/mol
D.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–1076.7 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com