
【题目】我国采用长征三号甲运载火箭成功发射了 “嫦娥一号” 卫星。肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) △H =+8.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是 ( )
A.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H=–1059.3 kJ/mo
B.N2H4(g) + ![]() N2O4(g) =
N2O4(g) =![]() N2(g) + 2H2O(g) △H=–542.7 kJ/mol
N2(g) + 2H2O(g) △H=–542.7 kJ/mol
C.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–542.7 kJ/mol
D.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–1076.7 kJ/mol
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是![]()
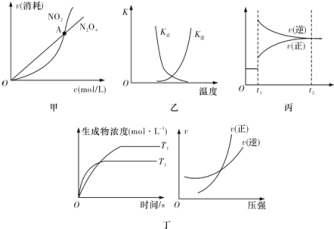
A.图甲表示在恒容密闭容器中,恒温条件下发生的可逆反应![]() ,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.图乙曲线表示反应![]() ,正、逆反应的平衡常数K随温度的变化
,正、逆反应的平衡常数K随温度的变化
C.图丙表示对反应![]() 在
在![]() 时刻增大压强
时刻增大压强
D.图丁表示反应![]() :
:![]() ;
;![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是制造有机磷农药和磺胺嘧啶类医药的原料,其制备方法是将熔融黄磷(P4)与干燥氯气进行氯化反应。
(1) PCl3遇水会强烈水解,写出PCl3与水反应的化学方程式:________。
(2) 制得的PCl3粗产品中常含有POCl3、PCl5等杂质。通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
a. 迅速移取20.00 g PCl3粗产品,加水完全水解后,再配成500.00 mL溶液;
b. 量取所配溶液25.00 mL于碘量瓶中,加入0.500 0 mol·L-1碘溶液20.00 mL和1.000 mol·L-1(NH4)3BO3溶液30.00 mL,振荡;
c. 加入2~3滴淀粉溶液,用1.000 0 mol·L-1 Na2S2O3标准溶液滴定过量的碘,滴至终点时消耗Na2S2O3标准溶液12.00 mL。
已知测定过程中的部分反应为H3PO3+H2O+I2![]() H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
①步骤b中加入(NH4)3BO3溶液的目的是________。
②判断步骤c中滴定终点的方法为________。
③根据上述数据,计算制得粗产品中PCl3的质量分数(写出计算过程)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:![]() ,达到平衡后测得A气体的浓度为
,达到平衡后测得A气体的浓度为![]() ,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为
,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.平衡向正反应方向移动B.![]()
C.B的物质的量浓度减小D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些共价键的键能数据如表(单位:kJmol-1):
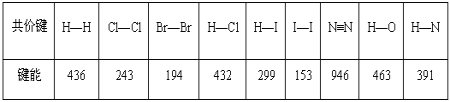
(1)把1mol Cl2分解为气态原子时,需要___(填“吸收”或“放出”)243kJ能量。
(2)由表中所列化学键形成的单质分子中,最稳定的是___;形成的化合物分子中最不稳定的是___。
(3)发射火箭时用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个压强不变的容器中,通入![]() 和
和![]() 及固体催化剂,使之反应:
及固体催化剂,使之反应:![]() ,平衡时容器内气体总的物质的量为起始时的
,平衡时容器内气体总的物质的量为起始时的![]() 。保持同一反应温度,在相同容器中,将起始物质的量改为
。保持同一反应温度,在相同容器中,将起始物质的量改为![]() 、
、![]() 、
、![]() ,下列说法正确的是
,下列说法正确的是
A.第一次平衡时反应放出的热量为![]()
B.第二次平衡![]() 的转化率为
的转化率为![]()
C.第二次达平衡时![]() 的体积分数大于
的体积分数大于![]()
D.达平衡时用![]() 表示的反应速率为
表示的反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为_____________________________________。
(2)下列实验能比较镁和铝的金属性强弱的是____________(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是_____________________________。
(4)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为______以上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu===Cu2++2Ag,设计的原电池如下图所示。

请回答下列问题:
(1)电极X的材料是________;Y是________。
(2)银电极为电池的________极,X电极上发生的电极反应为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质中通过传导Li+实现导电,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )

A.放电时,电子沿导线由A移向B,电解质溶液是含Li+的水溶液
B.充电时A为阴极,发生还原反应为C6+xLi++xe-=LixC6
C.放电时B为正极,电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2
D.废旧钴酸锂(LiCoO2)电池进行“充电处理”使锂进入石墨中而有利于回收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com