
【题目】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是

A. 该电池能在高温下工作
B. 该电池工作时,中间室中的Cl-移向右室
C. 正极上发生的电极反应:2NO3-+ 6H2O + 10e-═ N2 ↑+ 12OH-
D. 若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6 转移4 mol电子
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
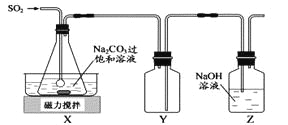
当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下某溶液中由水电离出的H+浓度为1.0×10﹣13molL﹣1,则在此溶液中一定不可能大量存在的离子组是( )
A. Al3+、K+、NO3﹣、Cl﹣ B. K+、Na+、HCO3﹣、Cl﹣
C. Na+、CO32﹣、SO42﹣、NO3﹣ D. Ba2+、Na+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇。如图是实验室中模拟工业原理制取无水乙醇的装置。

回答下列问题:
(1)指出图中的几处错误:____________________________。
(2)在除去工业酒精中的水时,下列做法不可取的是____________。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
(3)由(2)可知除去工业酒精中的水的原理是(用化学方程式表示):_____________。
(4)装置中仪器A、B、C的名称分别是:A____________;B_______________;C_____________。
(5)在蒸馏操作中,仪器B中加入沸石(或碎瓷片)的作用是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,向20 mL 0.1 mol·L-1的Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸(忽略H2CO3的分解和CO2的挥发),溶液pH随盐酸加入的体积变化曲线如图。下列说法正确的是

A. 点①所示溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B. 点②所示溶液中:c(CO32-)>c(Cl-)>c(HCO3-)>c(OH-)
C. 点③所示溶液中:c(OH-)﹣c(H+)=c(H2CO3)﹣c(CO32-)
D. 点④所示溶液中:c(Cl-)=2c(H2CO3) + c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明苯分子中碳碳键不是单、双键相间交替的事实是
①苯不能使酸性KMnO4溶液褪色 ②苯环中碳碳键均相同
③邻二甲苯只有一种 ④苯的对位二元取代物只有一种
⑤苯的邻位二氯代物只有一种 ⑥在一定条件下苯与H2发生加成反应生成环己
A. ①②③④⑤ B. ①②③⑤
C. ②③④⑤⑥ D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统医学治疗疟疾时将青蒿加水煮沸,但药效很差。改用乙醇控温60℃提取青蒿素,药效显著提高。屠呦呦用一种更适宜的物质从青蒿中提取青蒿素,这种提取物对疟原虫的抑制率达到了100%,这种适宜的物质是
A | B | C | D | |
物质 | 乙醚 | 四氯化碳 | 丙醇 | 煤油 |
沸点℃ | 34.5 | 76.5 | 97.4 | 180-310 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)有6.02×l023个H的H2O,其物质的量是_______;1molNa2SO4中所含的离子总数目为______。
(2)_____molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为_______。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为________。
(5)标准状况下,密度为0.75g·L-1的NH3与CH4组成的混合气体中,该混合气体对氢气的相对密度为____________。
(6)已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g)===S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。右图为H2S燃料电池的示意图。下列说法正确的是( )
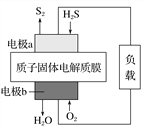
A. 电极a为电池的正极
B. 电极b上发生的电极反应为O2+2H2O+4e-===4OH-
C. 每有1 mol氧气参加反应,电池内部吸收632 kJ热能
D. 每34 g H2S参与反应,电路中有2 mol电子通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com