
| 2��7+2-8 |
| 2 |


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaHSO3��Һ����������Ϊ��HSO3-+H2O�TSO32-+H3O+ |
B���Ჴ���ᣨHO- -COOH����̼��������Һ��Ӧ��HO- -COOH����̼��������Һ��Ӧ��HO- -COOH+2HCO3-��-O- -COOH+2HCO3-��-O- -COO-+CO2��+2H2O -COO-+CO2��+2H2O |
| C������ʯ���ڴ���ķ�Ӧ��CaCO3+2CH3COOH�TCa2++2CH3COO-+CO2��+H2O |
| D��1L 2mol/L��FeBr2��Һ��ͨ��2.5molCl2��2Fe2++4Br-+3Cl2�T6Cl-+2Fe3++2Br2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
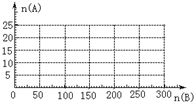 ��֪��4NH3+5O2
��֪��4NH3+5O2 | ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
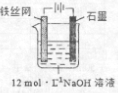 ������أ�K2FeO4����һ�ָ�Ч���ˮ�����������м�ǿ�������ԣ�
������أ�K2FeO4����һ�ָ�Ч���ˮ�����������м�ǿ�������ԣ�| �ɷ� | Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ�������κ�KNO2�Ȳ��� |
| ʪ�� | ǿ���Խ����У�Fe��NO3��3��NaClO��Ӧ�����Ϻ�ɫ����������Һ |
| ��ⷨ | �Ʊ��м����Na2FeO4������KOH��Һ��Ӧ |
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1-��ϩ |
| B����ϩ |
| C��2-��-2-��ϩ |
| D��2��3-����-2-��ϩ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com