
 已知:4NH3+5O2
已知:4NH3+5O2 | 催化剂 |
| △ |
| 3a |
| 4 |
| ||
| △ |
| 4×5 |
| 4×0.20 |
| 4L |
| 4L+25L |
| 5 |
| 4 |
| 1.5mol |
| 20.0mol |
| 18.0+1.5 |
| 20 |
| ||
| △ |
| ①+② |
| 2 |
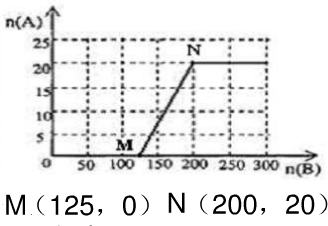
| n(O2) |
| n(NH3) |
| 5 |
| 4 |
| n(空气) |
| n(NH3) |
| 25 |
| 4 |
| 5 |
| 4 |
| 5 |
| 4 |
| n(O2) |
| n(NH3) |
| 2 |
| 1 |
| 25 |
| 4 |
| n(空气) |
| n(NH3) |
| 10 |
| 1 |
 ,
, .
.


科目:高中化学 来源: 题型:
| A、放在足量水中 |
| B、放在足量盐酸中 |
| C、放在足量CuSO4溶液中 |
| D、用刺有小孔的铝,包好放入足量水底中(假设铝不参加反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Tl是易导电的银白色的金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、Tl的还原性强于Al |
| D、Tl能生成+3价的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1120 | B、2240 |
| C、560 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2mol/L |
| B、2 mol/L |
| C、0.2 mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | A≡B | |
| C≡O | 357.7 | 798.9 | 1071.9 |
| N≡N | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠用于治疗胃溃疡病人的胃酸过多症 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、明矾用于净化生活用水 |
| D、Fe2O3用于制作红色染料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com