
| A、Tl是易导电的银白色的金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、Tl的还原性强于Al |
| D、Tl能生成+3价的化合物 |


科目:高中化学 来源: 题型:
| A、硅是一种重要的半导体材料,可作光导纤维 |
| B、目前,我国加碘食盐中主要添加的是KIO3 |
| C、酸雨是指pH<7的雨水,主要由于空气中SO2含量偏高引起 |
| D、在空气质量日报中CO2、SO2、氮氧化合物和可吸入颗粒物含量均属于空气污染指数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3溶液显酸性是因为:HSO3-+H2O═SO32-+H3O+ |
B、尼泊金酸(HO- -COOH)与碳酸氢钠溶液反应:HO- -COOH)与碳酸氢钠溶液反应:HO- -COOH+2HCO3-→-O- -COOH+2HCO3-→-O- -COO-+CO2↑+2H2O -COO-+CO2↑+2H2O |
| C、大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
| D、1L 2mol/L的FeBr2溶液中通入2.5molCl2:2Fe2++4Br-+3Cl2═6Cl-+2Fe3++2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Be2+中的质子和电子 | ||
B、
| ||
| C、NaHCO3中的阳离子和阴离子 | ||
| D、Na2O2中的阴离子和阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中通入氯气:Cl2+H2O═H++Cl-+HClO | ||||
B、在AlCl3溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH
| ||||
C、将过量SO2通入Ca(ClO)2溶液中:Ca 2++ClO-+SO2+H2O
| ||||
D、向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>③ |
| B、②>③>① |
| C、①=②=③ |
| D、③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
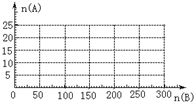 已知:4NH3+5O2
已知:4NH3+5O2 | 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
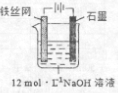 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com