
【题目】体积不变的密闭容器中充入H2和I2 , 发生反应H2(g)+I2(g) 2HI(g);(正反应为吸热反应),当达到平衡后,t0时升高温度,下列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.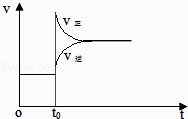 改变条件前后,速率图像为(如图)
改变条件前后,速率图像为(如图)
【答案】D
【解析】解:向一体积不变的密闭容器中充入H2和I2 , 发生反应H2(g)+I2(g)2HI(g)△H<0,当达到平衡后,t1时刻改变的条件为升高温度,升高温度正、逆反应速率均增大,但是逆反应速率大于正反应速率,反应逆向移动,A.平衡向逆反应移动,I2的浓度增大,容器内气体的颜色变深,混合气体的总质量不变,物质的量不变,故混合气体的平均相对分子质量不变,故A错误;
B.升高温度正、逆反应速率均增大,但是逆反应速率大于正反应速率,平衡向逆反应移动,质量、体积不不变,则密度不变,故B错误;
C.平衡向逆反应移动,H2(g)的转化率降低,HI的平衡浓度减小,故C错误;
D.升高温度正、逆反应速率均增大,逆反应速率大于正反应速率,反应逆向移动,而图像中符合,故D正确;
故选D.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸氢钠溶液与少量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B. 氯化铵与氢氧化钠两种溶液混合加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
C. 钠和冷水反应:Na+2H2O==Na++2OH-+H2↑
D. 向氯化铝溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是:( )
A. H+、Na+、CO32- B. Cl-、Ba2+、SO42-
C. H+、Ag+、NO3- D. H+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2O(g)═H2O(l)△H1=﹣Q1 kJmol﹣1②CH3OH(g)═CH3OH(l)△H2=﹣Q2 kJmol﹣1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=﹣Q3 kJmol﹣1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3
B.0.5Q3﹣Q2+2Q1
C.0.5Q3+Q2﹣2Q1
D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示.下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示.下列说法中正确是( ) 
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(Ls)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是___________(填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废铜屑可制备CuSO4,实现“变废为宝”。若将该反应设计成原电池,则正极的电极反应式为________________。
(3)氧化亚铜(CuCl)是微溶于水、易被氧化的白色固体,广泛用作有机合成催化剂、化学分析试剂等。用NH4NO3氧化海绵铜(含Cu和CuO)制备氯化亚铜的部分流程如下:

①步骤Ⅰ中,当0.2molNH4NO3参加反应时,反应中有1mol电子发生转移,则铜参加反应的离子方程式为________________________。
②步骤Ⅱ中充分反应后,分离出产品的方法是_________________。
③步骤Ⅱ中物质X可选用_________________(填字母)
a.SO2 b.Cl2 c.H2O2 d.(NH4)2SO3
该物质需过量的原因之一是加快反应速率,另一原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示。常温下,Al能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
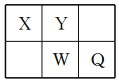
A. Y的最高化合价为+6
B. 简单氢化物的稳定性:Y>W
C. 简单离子半径:W>Q>Y>X
D. X、Y、W不可能同时存在于一种离子化合物中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com