
【题目】已知:①H2O(g)═H2O(l)△H1=﹣Q1 kJmol﹣1②CH3OH(g)═CH3OH(l)△H2=﹣Q2 kJmol﹣1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=﹣Q3 kJmol﹣1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3
B.0.5Q3﹣Q2+2Q1
C.0.5Q3+Q2﹣2Q1
D.0.5(Q1+Q2+Q3)
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种核电荷数依次增加的短周期元素, A 的原子中没有中子,B 原子的最外层电子数是内层电子数的两倍,C是短周期元素中金属性最强的, D和C相邻, E和F的最高价氧化物对应的水化物都是强酸。回答下列问题:
(1)写出B在元素周期表中的位置_______,C的离子结构示意图_______________。
(2)E的最简单氢化物的电子式_____________。F的最高价氧化物对应的水化物的化学式_______________。
(3)证明C比D活泼的实验依据是_______________。
(4)单质D在 B的最高氧化物中燃烧的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g)![]() 2C(g),若维持温度和压强不变,当达到平衡时,容器的体积为2L,其中C气体的体积占10%,下列推断正确的是
2C(g),若维持温度和压强不变,当达到平衡时,容器的体积为2L,其中C气体的体积占10%,下列推断正确的是
①原混合气体的体积为2.4L ②原混合气体的体积为2.2L
③反应达平衡时,气体A消耗掉0.1L ④反应达平衡时,气体B消耗掉0.1L
A. ②③ B. ②④ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.![]() 的名称为2﹣甲基﹣1﹣丙醇
的名称为2﹣甲基﹣1﹣丙醇
B.氯乙烯和聚乙烯均能发生加成反应
C.C3H2Cl6 有4种同分异构体
D.C2H4和C4H8一定是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积不变的密闭容器中充入H2和I2 , 发生反应H2(g)+I2(g) 2HI(g);(正反应为吸热反应),当达到平衡后,t0时升高温度,下列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.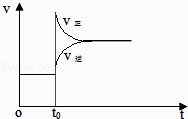 改变条件前后,速率图像为(如图)
改变条件前后,速率图像为(如图)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].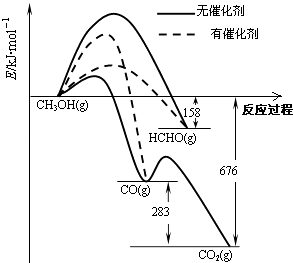
(1)①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
(2)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
(3)利用钠碱循环法可除去SO2 , 消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.水的电离是吸热过程,升高温度,水的离子积增大、pH减小
B.用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g)
C.对于平衡2HI(g)I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
D.由反应SiO2+2C ![]() Si+2CO↑,可得出C的非金属性强于Si
Si+2CO↑,可得出C的非金属性强于Si
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com