
【题目】氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________, 氯化钾需要“干燥”的原因是_____________。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
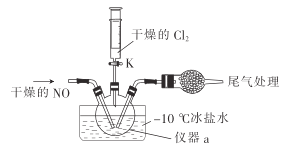
①仪器a的名称为__________。
②干燥管中盛放的试剂为____________。
③生成NOCl的化学方程式为________________。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式_______ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为___________ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为___________ |
【答案】KNO3 防止生成的氯化亚硝酰遇水反应,降低产率,防止NO2与水反应 三颈烧瓶 无水CaC12 2NO+C12 ==2NOC1 NOC1+H2O = HC1+HNO2 白色沉淀部分溶解 溶液紫红色褪色
【解析】
(1)根据氧化还原反应写出KCl与NO2反应方程式,根据题知氯化亚硝酰遇水反应,NO2与水反应,因此氯化钾需要“干燥”。
(2)①根据图得到仪器a的名称;②三颈烧瓶中需要干燥的环境,气体反应后需要将多余气体进行尾气处理,尾气处理在后续装置中进行,因此需要用干燥管隔开;③NO与Cl2反应生成NOCl。
(3)①NOCl与H2O反应生成HCl和HNO2;②加入足量AgNO3溶液,根据信息分析得到结论;③向步骤②烧杯中滴加酸性KMnO4溶液,根据信息HNO2既有氧化性又有还原性得出结论。
(1)反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,根据氧化还原反应得到KCl + 2NO2 = NOCl + KNO3,因此该盐的化学式为KNO3, 根据题知氯化亚硝酰遇水反应,NO2与水反应,因此氯化钾需要“干燥”;故答案为:KNO3;防止生成的氯化亚硝酰遇水反应,降低产率,防止NO2与水反应。
(2)①仪器a的名称为三颈烧瓶;故答案为:三颈烧瓶。
②三颈烧瓶中需要干燥的环境,气体反应后需要将多余气体进行尾气处理,尾气处理在后续装置中进行,因此需要用干燥管隔开,干燥管中盛放的试剂为无水CaC12;故答案为:无水CaC12。
③NO与Cl2反应生成NOCl,其化学方程式为2NO+Cl2 = 2NOCl;故答案为:2NO+Cl2 = 2NOCl。
(3)①NOCl与H2O反应的化学方程式NOCl+H2O = HCl+HNO2;故答案为:NOCl+H2O = HCl+HNO2。
②足量AgNO3溶液,有白色沉淀生成,白色沉淀为AgCl、AgNO2,加入稀硝酸后,根据信息AgNO2 + HNO3 =AgNO3+ HNO2,则实验现象为白色沉淀部分溶解;故答案为:白色沉淀部分溶解。
③向步骤②烧杯中滴加酸性KMnO4溶液,根据信息HNO2既有氧化性又有还原性,因此HNO2与KMnO4溶液发生氧化还原反应,则实验现象为溶液紫红色褪色;故答案为:溶液紫红色褪色。


科目:高中化学 来源: 题型:
【题目】1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的过程如下:
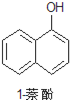 +CH3CH2OH
+CH3CH2OH![]()
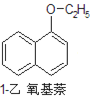 +H2O
+H2O
已知:1萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | 114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将一定量1萘酚溶于无水乙醇中,并加入少量浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是__________。
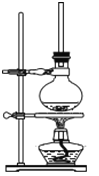
(2)装置中长玻璃管的作用是:______。
(3)该反应不能用实验室制备乙酸乙酯的装置,简述理由____________;
(4)反应结束,需要提纯产物,在下面的横线上填上相应操作的名称:倒入冷水,碱洗并_______ → 水洗并_______ →加入CaCl2干燥并______→___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: 25℃、101 kPa时,
I.H2(g) + ![]() O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + ![]() O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
试回答下列问题:
①能表示氢气燃烧热的热化学方程式为____ (填“I” 或“II”)
②H2O(g) = H2O(l) △H = ___ kJ/mol。
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
①放出的热量___41.0kJ(填“>”、“<”或“=”);
②该反应的平衡常数表达式K =__
③其他条件不变时,升高温度,c(H2)将__
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈___(填“酸性”、 “碱性”或“中性");
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=__( 已知Ksp[Fe(OH)3]= 4.0×10-38)。
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是__(填 “a”或“b”);②有关溶液变化的描述正确的是______;
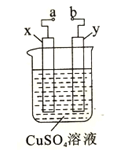
A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A.2.5 g NaD与足量水反应生成的氢气中含中子数0. 1NA
B.0.1 mol H2O与0. 1 mol H2O2含H—O键数目均为0. 2NA
C.0.1 mol Na2CO3NaHCO32H2O溶于水形成的1 L溶液中CO32一和HCO3一数目之和为0.2NA
D.电解精炼铜时,阴极增重64 g时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.1000 mol· L -1的NaOH溶液滴定0. 1000 mol· L -1的顺丁烯二酸H2A的滴定曲线如下图所示(pKa= lgKa),下列说法错误的是
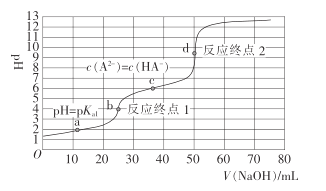
A.用NaOH溶液滴定NaHA溶液可用酚酞作指示剂
B.a点:c(HA-)=c(H2A)
C.H2A的Ka2=10-6
D.d点:c(Na+)<c(HA-)+2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式是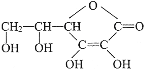 ,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23、三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3+ Br2+ 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为________,每生成2.24 LO2(标准状况)转移电子数为__________。
24、在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是________________________,相应的离子方程式是_______________________。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) ---------------①
Cl2(aq) ---------------①
Cl2(aq)+ H2O![]() HClO + H++Cl------②
HClO + H++Cl------②
HClO![]() H++ ClO----------------③
H++ ClO----------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
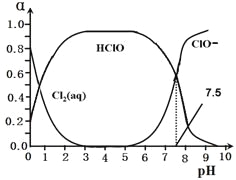
25、写出上述体系中属于电离平衡的平衡常数表达式:Ki =_______,由图可知该常数值为_________。
26、在该体系中c(HClO) + c(ClO-)_______c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
27、用氯处理饮用水时,夏季的杀菌效果比冬季______(填“好”或“差”),请用勒夏特列原理解释________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
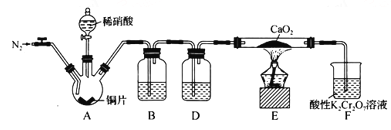
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃C5H12有三种同分异构体,有关它们的结构和性质的说法不正确的是( )
A.三种同分异构体在常温常压下均为液体
B.其中一种同分异构体的碳原子间结构:具有空间正四面体对称结构
C.三种同分异构体具有相同的分子式.相对原子质量,化学性质相似
D.C5H11Cl共有8种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com