

科目:高中化学 来源: 题型:

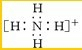 ,能
,能 ,能
,能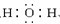 ,能
,能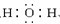 ,能
,能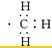 ,不能
,不能 ,不能
,不能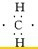 ,不能
,不能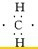 ,不能
,不能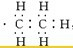 ,不能
,不能 ,不能
,不能查看答案和解析>>
科目:高中化学 来源: 题型:
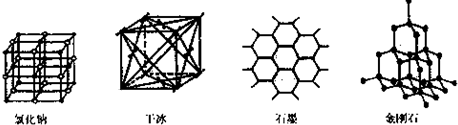
查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市高三上学期12月月考理综化学试卷(解析版) 题型:实验题
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
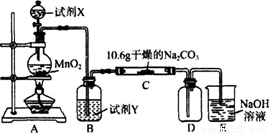
(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分: NaHCO3和__________
假设二:存在三种成分: NaHCO3和__________、___________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
|
步骤2:向A试管中滴加______________: |
①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
|
步骤3:向B试管中滴加______________: |
若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立。 |
(4)己知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=___________(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有______________________。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
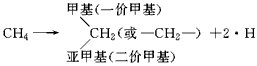
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com