
| A、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、氢氧化钠溶液吸收过量的二氧化碳:2OH-+CO2=CO32-+H2O |
| D、铝与氢氧化钠溶液反应:Al+OH-+H2O=AlO2-+H2↑ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
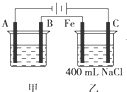 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);△H=-akJ?mol-1 | ||||
B、CH3CH2OH(l)+
| ||||
C、C(s)+
| ||||
D、NH3(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯离子的结构示意图: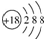 | ||
| B、明矾的化学式:KAl(SO4)2 | ||
C、中子数为10的氧原子:
| ||
D、溴化铵的电子式: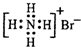 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol任何气体的体积都约是22.4 L |
| B、标准状况时,氧气的体积约是22.4 L |
| C、1 molH2和1 molH2O在标准状况下体积都约是22.4 L |
| D、1 mol任何气体在标准状况下所占体积都约是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NH4Cl | Na2O | CO |
| C | NH3?H2O | CH3COOH | NaCl | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
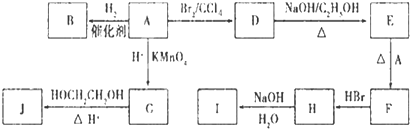
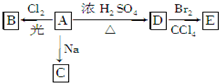 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com