
| V |
| Vm |
| n |
| v |
| n |
| v |
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
| n |
| v |
| 1mol |
| 0.25mL |
| n |
| v |
| 1mol |
| 1L |


科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:丙<丁<戊 |
| B、金属性:甲<丙 |
| C、氢氧化物碱性:丙>丁>戊 |
| D、最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.01mol?L-1NH4Cl溶液 |
| B、25℃时,0.01mol?L-1NaHSO4溶液 |
| C、100℃时,0.01mol?L-1NaNO3溶液 |
| D、25℃时,0.01mol?L-1NaF溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3═2Al3++3SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═CH3COO-+H+ |
| D、Na2CO3═Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
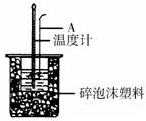
| A、稍过量的氢氧化钠是确保盐酸完全反应 |
| B、仪器A的名称是环形玻璃搅拌棒 |
| C、在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D、用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20℃,10 mL 0.1mol?L-1硫酸 |
| B、20℃,5 mL 0.1 mol?L-1硫酸和5 mL水 |
| C、30℃,10 mL 1 mol?L-1硫酸 |
| D、30℃,5 mL 1 mol?L-1硫酸和5 mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Cu可以分别用电解冶炼法、热还原法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
| A、达到化学平衡时,N2将完全转化为NH3 |
| B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D、达到化学平衡时,正反应和逆反应的速率都为零 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com