
已知:CO(g)+H2O(g) CO2(g)+H2(g) H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
n(CO) | n(H2O) | n(CO2) | n(H2) | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L·min)
B.容器③中,开始时υ(CO)生成>υ(CO)消耗
C.达平衡过程体系能量的变化:Q1=4Q2
D.平衡时,①与②容器中CO的体积分数相等
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是
A.CO2 B.NH3 C.H2S D.Cl2
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
某温度下,反应SO2(g)+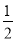 O2(g)
O2(g) SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为
2SO2(g)+O2(g)的平衡常数K2的值为
A.2500 B.100 C.4×10-4 D.2×10-2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:推断题
(18分)以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。

(1)A分子中的官能团名称是 、 。
(2)A的结构简式____________________
A的一种同分异构体属于乙酸酯,其结构简式是 。
(3)B转化为C的化学方程式是 ,其反应类型是 。
II.用烃C或苯合成PMLA的路线如下。
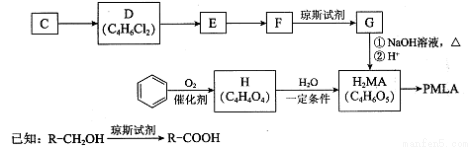
(4)1 mol有机物H与足量NaHC03溶液反应生成标准状况下的C02 44.8L,H有顺反异构,其反式结构简式是 。H的核磁共振氢谱有______种峰(反式结构)。
(5)E的结构简式是 。
(6)G与NaOH溶液在加热条件下反应的化学方程式是 。
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
化学与人类生产,生活密切相关。下列有关说法不正确的是
A.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
B.福尔马林可浸制标本,利用了其使蛋白质变性的性质
C.医用酒精使用淀粉类植物发酵经蒸馏制成,浓度通常为75%
D.绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
氰化氢(HCN)主要应用于电镀业,其制备的化学方程式为:C2H4+NH3=HCN+CH4+H2,下列说法不正确的是
A.C2H4分子中所有原子共平面 B.C2H4既作氧化剂,又作还原剂
C.HCN分子中既含σ键又含π键 D.转移0.2mol电子,生成2.24L H2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的X和Y,发生反应:x(g)+aY(g) 2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是
2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是

容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.0molX 0.5molY | 1.0molX 0.5molY | 4.0molX 2.0molY |
A.该反应温度升高,平衡常数减小
B.20min内甲容器中反应的平均速率: v(X) = 0.075mol·(L·min)-1
C.其他条件不变,若缩小乙的体积,Y的转化率不变
D.10min时,其他条件不变,向乙容器中再加入2 molZ,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:推断题
选做(12分)【化学一有机化学基础】 聚谷氨酸(
聚谷氨酸( )是一种具有水溶性、可生物降解、可食用的对人体和环境无毒的高分子聚合物,广泛应用于食品和医药等领域。下图是根据实际需要和目的,对
)是一种具有水溶性、可生物降解、可食用的对人体和环境无毒的高分子聚合物,广泛应用于食品和医药等领域。下图是根据实际需要和目的,对 聚谷氨酸
聚谷氨酸 中的羧基进行化学修饰的路线,其中B、C、F均为高分子化合物。
中的羧基进行化学修饰的路线,其中B、C、F均为高分子化合物。

请回答:
(1)C的单体的结构简式为__________。D→E的反应类型是_________。
(2) 与NaHCO3溶液反应,可观察到的实验现象是_________。
与NaHCO3溶液反应,可观察到的实验现象是_________。
(3)下列关于CH3CH=CH2的说法中,正确的是__________(填字母序号)。
a.能使KMnO4酸性溶液褪色
b.它的同分异构体环丙烷属于不饱和烃
c.与HBr发生加成反应可得到两种产物
d.可以用溴的四氯化碳溶液鉴别丙烯和丙炔
(4)D的核磁共振氢谱有4个吸收峰,D发生银镜反应的化学方程式为:______________________。
(5)E与邻苯二甲酸 反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一。DBP有多种同分异构体,其中符合下列条件的DBP的结构简式_____________________
反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一。DBP有多种同分异构体,其中符合下列条件的DBP的结构简式_____________________
a.1mol化合物能与2molNaHCO3反应
b.苯环上只有两个相同的无支链取代基
c.苯环上的一氯取代物有三种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东肥城市高三一模理综化学试卷(解析版) 题型:实验题
(19分)FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,实验室用KMnO4溶液通过氧化还原滴定测定某补血剂(1.500 g)中铁元素的含量。
①配制100 mL 1.200 × 10 —2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为_____________________。滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
(4)某实验小组用久置的FeSO4溶液和NaOH溶液制备Fe(OH)2,实验后没有得到预期的白色沉淀,于是采用下列试剂(已煮沸除氧)和装置进行实验:

实验开始打开止水夹C,目的是_______________________。一段时间后,关闭止水夹C, B中观察到的现象是______________________。B中发生反应的离子方程式是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com