
【题目】有A、B、C、D、E五种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE, D的单质是黄绿色气体,常温下E的单质是液体。
请回答:
(1)B在周期表中的位置__________,C的原子结构示意图是__________。
(2)E单质的化学式是___________。
(3)上述五种元素中,所形成的最高价氧化物对应的水化物的酸性最强的物质是_____(化学式)。
(4)写出C的氧化物与A的最高价氧化物对应的水化物反应的离子方程式________
【答案】第3周期 ⅡA 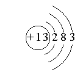 Br2 HClO4 Al2O3+2OH-=2AlO2-+H2O
Br2 HClO4 Al2O3+2OH-=2AlO2-+H2O
【解析】
A、B、C、D、E五种元素,由①知A、B、C均为第3周期的金属元素(只有Na、Mg、Al),A的原子半径在所属周期中最大,且原子半径A>B>C,则A为Na、B为Mg、C为Al;由②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,则D、E处于ⅦA族,D的单质是黄绿色气体,常温下E的单质是液体,则D为Cl、E为Br。
(1)B为Mg,在周期表中的位置:第3周期ⅡA族,C为Al,原子结构示意图是 ![]() ;
;
(2)E为Br元素,单质的化学式是Br2;
(3)上述五种元素中,非金属性最强的是Cl元素,则所形成的最高价氧化物对应的水化物的酸性最强的物质是HClO4;
(4)C的氧化物为Al2O3,A的最高价氧化物对应的水化物为NaOH,二者反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备,下列说法正确的是
SiO2 ![]() Si(粗)
Si(粗) 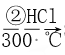 SiHCl3
SiHCl3 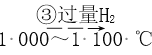 Si(纯)
Si(纯)
A. 步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①、②、③中每生成或反应1 mol Si,转移2 mol电子
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,配制一组c(H2A)+ c(HA-)+ c(A2-)=0.100 mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法正确的是

A. H2A在水中的电离方程式为:H2A=HA-+ H+,HA-![]() H++A2-
H++A2-
B. c(Na+)=0.100 mol·L-1的溶液中,c(H+)+c(H2A)=c(OH-)+ c(A2-)
C. pH=4的溶液中,c(HA-)>c(H2A)+ c(A2-)
D. pH=7的溶液中,c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池反应为:Pb + PbO2 + 2H2SO4![]() 2PbSO4 + 2H2O 。下列说法中正确的是
2PbSO4 + 2H2O 。下列说法中正确的是
A. PbO2得电子,被氧化
B. 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g
C. 电流是由PbO2经外电路流向Pb
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化。在100 mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
(1)解释2 min~3 min反应速率最大的原因______;反应速率最小的时间段是_____,原因为____。
(2)在4min~5 min时间段内,用盐酸的浓度变化表示的反应速率为____。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A. Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。
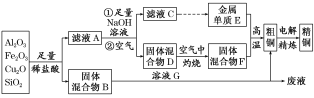
(1)滤液A中铁元素的存在形式为________________(填离子符号),生成该离子的离子方程式为____________________________,检验滤液A中存在该离子的试剂为__________________。
(2)溶液G与固体混合物B反应的离子方程式为__________________________________________________。
(3)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 反应A(g) ![]() 2B(g) ΔH,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则ΔH=-(Ea-Eb) kJ/mol
2B(g) ΔH,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则ΔH=-(Ea-Eb) kJ/mol
B. 某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C. 将0.2 mol/L 的CH3COOH 溶液与0.1 mol/L 的NaOH 溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
D. 将浓度为0.1 mol/L HF 溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
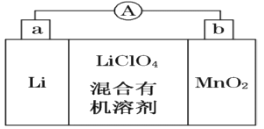
回答下列问题:
(1)外电路的电流方向是由______极流向______极。(填字母)
(2)电池正极反应式为 _____________________。
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 _________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为__________。
(4)电解Na2CO3溶液,原理如图所示。
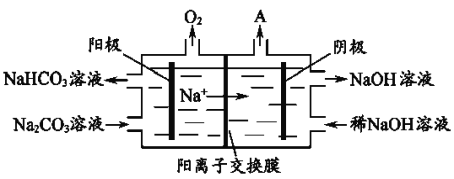
阳极的电极反应式为__________________,阴极产生的物质A的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com