
高锰酸钾在实验室和工农业生产中有广泛的用途.实验室以二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步加热熔融应在 中进行.而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通入CO2,可以使Mn片发生反应.生成MnO4—和MnO2。反应的离子方程式为 。则完成反应时,转化为KMnO4的占全部K2MnO4的百分率约为 (精确到0.1%)。
(3)第⑤步趁热过滤的是 。
(4)第⑥步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、 、洗涤、干燥。干燥过程中.温度不宜过高.其原因是 (用化学方程式表示)。
(5)H2O2和KMnO4,都是常用的强氧化剂。若向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色.写出该反应的离子方程式: .该反应说明H2O2的氧化性比KMnO4 (填“强”或“弱”)。
(1)铁坩埚;SiO2+2KOH K2SiO3+H2O
K2SiO3+H2O
(2)3MnO42-+2CO2 2MnO4-MnO2↓+2CO32-(或其他合理答案);66.7%
2MnO4-MnO2↓+2CO32-(或其他合理答案);66.7%
(3)减少过滤的损耗(或防止降温过程中KMnO4析出而损耗)
(4)过滤;2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(5)2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O;弱
解析试题分析:(1)由于KOH是强碱,在加热及高温时容易与玻璃、陶瓷中的SiO2发生反应,该反应的方程式为:SiO2+2KOH K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。(2)根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2CO2
K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。(2)根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2CO2 2MnO4-+MnO2↓+2CO32-。由方程式可看出,每有3mol的K2MnO4发生反应,就生成2mol的KMnO4。所以转化为KMnO4的K2MnO4的转化率为:2÷3×100%=66.7%。(3)由于KMnO4的溶解度随温度的升高而增大,随温度的降低而减小。趁热过滤就可以减少过滤过程中KMnO4的损耗。(4)第⑥ 步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4
2MnO4-+MnO2↓+2CO32-。由方程式可看出,每有3mol的K2MnO4发生反应,就生成2mol的KMnO4。所以转化为KMnO4的K2MnO4的转化率为:2÷3×100%=66.7%。(3)由于KMnO4的溶解度随温度的升高而增大,随温度的降低而减小。趁热过滤就可以减少过滤过程中KMnO4的损耗。(4)第⑥ 步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4 K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(5)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色。该反应说明H2O2的氧化性比KMnO4弱。
K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(5)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色。该反应说明H2O2的氧化性比KMnO4弱。
考点:考查化学实验基本操作、化学方程式和离子方程式的书写、高锰酸钾的制法、性质、产率的计算等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:__________________________________________________________;
实验②:__________________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 |
| C.Br2>Fe3+ | D.I->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式:________________________________________。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________________。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是
________________________________________________________________________。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。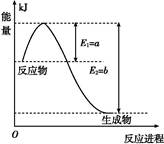
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 |
| C.使用催化剂 | D.降低温度 |
 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、SO42-、CO32-两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解
C溶液 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解
D溶液 白色沉淀
白色沉淀 沉淀部分溶解
沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:A________;B________;C________;D________;
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式为_________________________________________________________________。
(3)③中若向C溶液中滴入D溶液,可能出现的实验现象是_________________________________________________________________。
用离子方程式表示其原因:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:______________________________________________________;
实验②:______________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 | C.Br2>Fe3+ | D.I->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3—、CO32—、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.SO32— B.SO42— C.CH3COO- D.SiO32—
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为_________________________________________________________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为0.1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1)若向该溶液中加入过量的稀硫酸和KSCN溶液,现象是: ;
(2)写出向该溶液中加入过量的稀硫酸发生反应的离子方程式为:________________________________________________________________________;
(3)经分析,该溶液仅含的4种离子是:______________________________________;
(4)判定另外3种离子不能存在的主要依据有三个:
①向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变,②所含离子的物质的量均为0.1mol,则③是__________________________________________;
(5) 若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,最后所得固体的质量为______g
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法标出电子转移情况: 。
(2)生活中常用食醋除去水壶中的水垢(主要成分是碳酸钙固体)的离子方程为: 。
(3)钢铁在潮湿环境中溶液锈蚀,反应的氧化剂是 。工业上常用稀硫酸进行焊接前除锈(主要成分是Fe2O3?xH2O),反应的离子方程为: 。
(4)医疗上常用小苏打治疗胃酸过多,小苏打溶液与盐酸反应的离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com