
【题目】物质有以下转化关系:
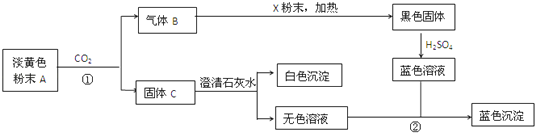
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是 ,B是 ,C是 ,X粉末是 ..
(2)写出反应①的化学方程式 .
(3)写出反应②的离子方程式 .
【答案】(1)Na2O2;O2;Na2CO3;Cu;(各1分)
(2)2Na2O2+2CO2=2Na2CO3+O2;(2分)
Cu2++2OH﹣=Cu(OH)2↓(2分)
【解析】
试题分析:淡黄色粉末A能与二氧化碳反应,因此A是过氧化钠,B是氧气,C是碳酸钠。碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠和蓝色溶液反应产生蓝色沉淀,说明是氢氧化铜沉淀,试题X是铜,黑色固体是氧化铜,和稀硫酸反应生成硫酸铜。
(1)根据以上分析可知A、B、C、X分别是Na2O2、O2、Na2CO3、Cu;
(2)反应①的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;反应②的离子方程式为Cu2++2OH﹣=Cu(OH)2↓。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】关于组成细胞的元素、化合物的叙述,正确的是
A. 组成细胞的最基本元素有C、H、O、N
B. 细胞中含量最多的有机物是蛋白质
C. 微量元素不但含量少,而且作用也小
D. 不同细胞中含有的化学元素种类差距很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.活化分子之间的碰撞即为有效碰撞
B.使用催化剂能降低活化能,增加活化分子百分数
C.增大压强不能降低活化能,但能增加活化分子百分数
D.活化能的大小决定了反应能否自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:
NaClO2+HCl→ClO2↑+NaCl+H2O(没有配平)
(1)配平方程式。
![]() NaClO2+
NaClO2+![]() HCl—
HCl—![]() ClO2↑+
ClO2↑+![]() NaCl+
NaCl+![]() H2O
H2O
(2)该反应中氧化剂和还原剂的物质的量之比_______________________。生成0.2 mol ClO2转移电子的物质的量为________mol。
(3)ClO2对污水中的Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN- a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是分离混合物时常用的仪器,回答下列问题:
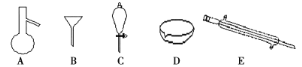
(1)写出上述仪器的名称:A___________,C________________,E________。
(2)分离以下混合物应该主要选用上述什么仪器(填字母)
①粗盐和泥沙:___________;②花生油和水:____________。
(3)关于仪器的使用,下列说法不正确的是________。
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于过滤
C.C仪器在放出液体时应打开上边的塞子
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.蒸馏时,E仪器中水的流向是上口进,下口出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?______________。
(5)下列是进行该操作的步骤,正确的顺序是___________。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接收溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.![]() 的溶液中:K+、NH4+、SO42-、NO3-
的溶液中:K+、NH4+、SO42-、NO3-
B.0.1 mol/L NaAlO2溶液:Fe3+ 、H+、Cl-、SO42-
C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
D.使甲基橙试液显黄色的溶液:Fe2+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
B.FeSO4溶液中加入酸性H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O
C.Cl2和水反应:Cl2+H2O=2H++Cl-+ClO-
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2![]() I2+2H2O
I2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com