
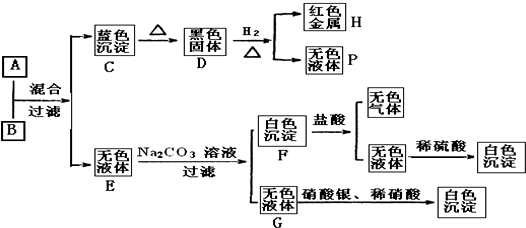
分析 由转化关系图可知,红色金属H为Cu,蓝色沉淀C为Cu(OH)2,加热氢氧化铜时,氢氧化铜分解生成黑色固体D为CuO,氧化铜被氢气还原生成铜和水,所以P为H2O;
碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E和碳酸钠溶液反应生成白色沉淀F及G,G的溶液中加入硝酸银、硝酸得到白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2,F为碳酸盐,F和盐酸反应生成无色气体和无色溶液,该无色溶液和稀硫酸反应生成白色沉淀,故无色溶液含有Ba2+,故白色沉淀F为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2,验证符合转化关系.
解答 解:由转化关系图可知,红色金属H为Cu,蓝色沉淀C为Cu(OH)2,加热氢氧化铜时,氢氧化铜分解生成黑色固体D为CuO,氧化铜被氢气还原生成铜和水,所以P为H2O;
碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E和碳酸钠溶液反应生成白色沉淀F及G,G的溶液中加入硝酸银、硝酸得到白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2,F为碳酸盐,F和盐酸反应生成无色气体和无色溶液,该无色溶液和稀硫酸反应生成白色沉淀,故无色溶液含有Ba2+,故白色沉淀F为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2,验证符合转化关系,
(1)通过以上分析知,A溶液和B溶液的溶质分别是Ba(OH)2、CuCl2,故答案为:Ba(OH)2、CuCl2;
(2)①A+B→C+E是氢氧化钡与氯化铜反应生成氢氧化铜与氯化钡,反应离子方程式为:Cu2++2OH-=Cu(OH)2↓;
②D+H2→H+P是氢气和氧化铜发生氧化还原反应生成铜和水,反应方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
③E+Na2CO3→F+G是氯化钡与碳酸钠反应生成碳酸钡与氯化钠,反应离子方程式为:Ba2++CO32-=BaCO3↓;
④F+盐酸→I+E是碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:Cu2++2OH-=Cu(OH)2↓;H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;Ba2++CO32-=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O.
点评 本题考查无机物推断,题目以无机框图题的形式考查C、Cu、Cl、S等元素单质及其化合物之间的相互转化关系、离子检验和逻辑推理能力、化学用语的书写能力,本题中H为红色金属,C为蓝色沉淀,D为黑色固体,P为无色液体等均为解题突破口,再结合转化关系利用逆推与顺推相结合进行推理判断,对学生的逻辑推理能力有较高要求,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 用托盘天平称取5.20g氯化钠 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖在一定条件下可发生银镜反应 | |
| B. | 蔗糖和麦芽糖互为同分异构体 | |
| C. | 淀粉和纤维素互为同分异构体 | |
| D. | 油脂在体内酶的催化下水解得高级脂肪酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ba2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、NO3- | D. | Mg2+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能为电解池反应,Fe做阴极,CuSO4溶液做电解液 | |
| B. | 可能为原电池反应,负极Fe被还原为Fe2+ | |
| C. | 可能为电解池反应,阳极反应:Fe-2e-═Fe2+ | |
| D. | 可能为原电池反应,Fe做负极,Zn做正极,CuSO4溶液为电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com