
| A、①② | B、②③ | C、①③ | D、②④ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为提高农作物的产量和质量,应大量使用化肥和农药 |
| B、装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| C、氯气本身有毒,可以直接杀死水中的细菌和病毒,所以液氯可用于自来水的消毒剂 |
| D、棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当溶液中c(CH3COO-)=c (Na+)>c (H+)=c(OH-)时,一定是醋酸过量 |
| B、当溶液中c (CH3COO-)=c (Na+)时,一定是氢氧化钠过量 |
| C、当溶液中c (CH3COO-)=c (Na+)时,醋酸与氢氧化钠恰好完全反应 |
| D、当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,体积相等、pH=3的盐酸和醋酸,中和NaOH溶液的能力,盐酸小于醋酸 | ||
B、 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与率起始时两物质的物质的量之比
| ||
C、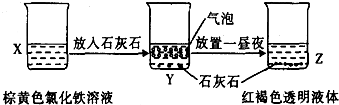 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+ | ||
D、在25℃时,将amo1?L-l的氨水与0.01 moI?L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验现象或结论 | 原因或原理 |
| A | 铜丝在硫蒸气中燃烧生成黑色物质 | Cu+S=CuS |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuCl2的Ksp比Zn Cl2的Ksp小 |
| C | MgO可以除去MgCl2溶液中的FeCl3 | MgO消耗了溶液中的H+,碱性增强,使Fe3+沉淀下来 |
| D | 向豆浆中加入硫酸钙可制成豆腐 | 硫酸钙转化为更难溶的沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通过无水氯化钙粉末 |
| B、氢气通过灼热的氧化铜粉末 |
| C、铝与氧化铁发生铝热反应 |
| D、将锌粒投入到硝酸铜溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

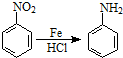 .2CH3CHO
.2CH3CHO| NaOH |
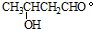
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com