
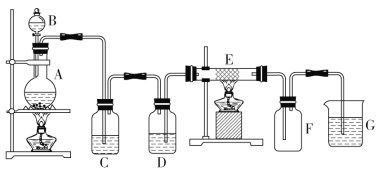
����Ŀ��ijѧ����������װ����ȡ����FeCl3���塣����A��Cl2�ķ���װ�ã�C��DΪ���徻��װ�ã�EӲ�ʲ�������װ��ϸ��˿����FΪ����Ŀչ��ƿ���ձ�GΪβ������װ�á�
�Իش�
(1)��װ������һ���Դ�����____________������ĸ����
(2)D����װ�Լ�Ϊ_____________��Cװ�õ�������___________________��
(3)A�з�����Ӧ�Ļ�ѧ����ʽ��__________________��G�з�����Ӧ�����ӷ���ʽ��________________��
(4)����100mL 12mol/L����������MnO2��ַ�Ӧ�����ɵ�Cl2���(��״��)________(������������С��������������)6.72 L��
(5)������ȡ��FeCl3�����Ƴ�Fe(OH)3���壬���ֽ������Һ����________�����뽺�����Һ���õķ�����_______________��
���𰸡�װ��D ŨH2SO4 ��ȥCl2�е�HCl���� MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O Cl2+2OH-=Cl-+ClO-+H2O С�� �����ЧӦ ����
MnCl2+Cl2��+2H2O Cl2+2OH-=Cl-+ClO-+H2O С�� �����ЧӦ ����
��������
��װ��A����MnO2��HCl(Ũ)��ϼ�����ȡCl2��װ��C��ȥ����HCl��װ��D��ȥCl2�е�ˮ��������װ��E��Fe��Cl2��Ӧ����FeCl3��װ��F�ǰ�ȫƿ����ֹ��������ķ�����װ��G��β������װ�ã����ڳ�ȥδ��Ӧ��Cl2�����ݽ������Ĵ�С�����ж����ʵļ�����ᴿ��
(1)��װ��A����ȡCl2���÷�Ӧ��Ҫ���ȣ�HCl���лӷ��ԣ�������ȡ��Cl2�к�������HCl��H2O������װ��C��ȥHCl��װ��D��ȥˮ�������������dz����̳���װ��ͼ�е������Ƕ̽����������Ը�װ������һ���Դ�������װ��D��
(2)D����װ�Լ�ΪŨ���ᣬ�����Ǹ���Cl2��Cװ�õ������dz�ȥCl2�е�HCl��
(3)��A��MnO2��HCl(Ũ)��ϼ�����ȡCl2��������Ӧ�Ļ�ѧ����ʽ��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��G��Cl2��NaOH��Һ��Ӧ����NaCl��NaClO��H2O��������Ӧ�����ӷ���ʽ��Cl2+2OH-=Cl-+ClO-+H2O��
MnCl2+Cl2��+2H2O��G��Cl2��NaOH��Һ��Ӧ����NaCl��NaClO��H2O��������Ӧ�����ӷ���ʽ��Cl2+2OH-=Cl-+ClO-+H2O��
(4)����100mL 12mol/L����������MnO2��ַ�Ӧ��n(HCl)=12mol/L��0.1L=1.2mol����HCl��ȫ��Ӧ������ݷ�Ӧ����Cl2�����ʵ���n(Cl2)=1.2mol��4=0.3mol�����ڱ�״�����Ϊ6.72L����ʵ���ϣ����ŷ�Ӧ�Ľ��У�Ũ�����Ϊϡ���ᣬ��Ӧ�Ͳ��ٷ�������˷�Ӧ������Cl2�ڱ�״�������С��6.72L��
(5)������ȡ��FeCl3�����Ƴ�Fe(OH)3���壬���ֽ������Һ���ö����ЧӦ�����ڽ���������ͨ����Ĥ����Һ�����ܹ�ͨ����Ĥ�����Է��뽺�����Һ���õķ�����������


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.1 mol S��O2��Ħ����������32 g
B.23g NO2��N2O4�Ļ��������������Oԭ����ΪNA
C.1 mol�κ������ж�������ͬ��ԭ����
D.22.4 L CO2�����к���3NA��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K+��NH4+��Fe2+��Al3+��Cl-��SO42-��CO32-��AlO2-�е����������ӣ�����Ũ�Ⱦ�Ϊ0.1mol/L��ijͬѧ����������ʵ�飺
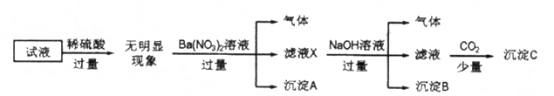
����˵����ȷ����
A. ��ȷ��ԭ��Һ���Ƿ���Al3+��Cl-
B. ��ҺX�д������ڵ���������NH4+��Fe2+��Ba2+
C. ԭ��Һ�д��ڵ�����ΪNH4+��Fe2+��Cl-��SO42-
D. ��ȷ������C�ijɷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1) ���������õ������£�NH![]() ����������Ӧ��������NO
����������Ӧ��������NO![]() ��������Ӧ�������仯ʾ��ͼ���£�
��������Ӧ�������仯ʾ��ͼ���£�

�� ��һ����Ӧ��________(����ȡ������ȡ�)��Ӧ���ж�������________________��
�� 1 mol NH![]() (aq)ȫ��������NO
(aq)ȫ��������NO![]() (aq)���Ȼ�ѧ����ʽ��_______________________��
(aq)���Ȼ�ѧ����ʽ��_______________________��
(2) ��֪���ױȰ����ȶ�����ӦP4(���ף�s)��5O2(g)===2P2O5(s)����H1��4P(���ף�s)��5O2(g)===2P2O5(s)����H2����H1�ͦ�H2�Ĺ�ϵ�Ǧ�H1________��H2 (�>����<������)��
(3) ��298 K��101 kPaʱ����֪��2H2O(g)===O2(g)��2H2(g)����H1
Cl2(g)��H2(g)===2HCl(g)����H2
2Cl2(g)��2H2O(g)===4HCl(g)��O2(g)����H3
��H3�릤H1�ͦ�H2֮��Ĺ�ϵ��ȷ����________��
A����H3����H1��2��H2 B����H3����H1����H2
C����H3����H1��2��H2 D����H3����H1����H2
(4) ��֪��
2CO(g)��O2(g)===2CO2(g) ��H����566 kJ��mol��1 ��
Na2O2(s)��CO2(g)===Na2CO3(s)��![]() O2(g) ��H����226 kJ��mol��1 ��
O2(g) ��H����226 kJ��mol��1 ��
��CO(g)��Na2O2(s)��Ӧ�ų�509 kJ����ʱ������ת����ĿΪ________________��
(5) ��֪H2(g)��Br2(l)===2HBr(g)����H����72 kJ��mol��1������1 mol Br2(l)��Ҫ���յ�����Ϊ30 kJ����������������±���
���� | H2(g) | Br2(g) | HBr(g) |
1 mol�����еĻ�ѧ���� ��ʱ��Ҫ���յ�����(kJ) | 436 | 200 | a |
�����a��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 0.1 mol H2�к��еķ�����Ϊ6.02��1022
B. 24 g Mg���Mg2��ʱʧȥ�ĵ�����Ϊ6.02��1023
C. 1 L 1 mol��L��1 CaCl2��Һ�к��е�Cl����Ϊ6.02��1023
D. ���³�ѹ�£�11.2 L O2�к��е�ԭ����Ϊ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˫��Ĥ(BP)������������Ĥ����ֱ����������£�������Ĥ���ϲ���H2O�����H+��OH-����ΪH+��OH-����Դ������˫��Ĥ�����������ʳ��ˮ�ɻ�õ�ˮ��NaOH��HC1���乤��ԭ������ͼ��ʾ��M��NΪ���ӽ���Ĥ��
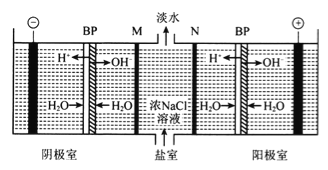
����˵���������
A. �����ҷ����ķ�ӦΪ2H++2e-=H2��
B. MΪ�����ӽ���Ĥ��NΪ�����ӽ���Ĥ
C. ��ȥ��˫��Ĥ(BP)�������һ���C12����
D. ��·��ÿת��1mol���ӣ��������õ�0.5 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
A.Fe��ϡH2SO4��Ӧ��2Fe + 6H+ =2Fe3+ + 3H2��
B.������ͭ��Һ�еμ�����������Һ��SO![]() ǡ�ó�����ȫ��Cu2����SO
ǡ�ó�����ȫ��Cu2����SO![]() ��2OH����Ba2��===Cu(OH)2����BaSO4��
��2OH����Ba2��===Cu(OH)2����BaSO4��
C.����������Һ�м����������ữ�Ĺ���������Һ��Fe2����2H����H2O2===Fe3����2H2O
D.̼����������Һ��Ӧ��CaCO3��2H��===Ca2����CO2����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������㷺�����ڶ�ֲ�����ڣ�����������������˵����ȷ����
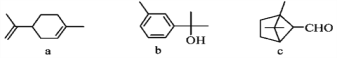
A. a��b�����ڷ����廯���� B. b��c����������Cu(OH)2��Һ��Ӧ
C. a��b��c����ʹ����KMnO4��Һ��ɫ D. b��c��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������˵�����ʾʽ��ȷ���ǣ� ��
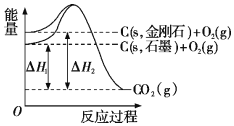
A.ʯī�ͽ��ʯ��ת���������仯
B.ʯī���ȶ������ڽ��ʯ
C.C��s��ʯī����C��s�����ʯ���Ƿ��ȷ�Ӧ
D.��ͬ������ʯī�ͽ��ʯ��ȫȼ������CO2���壬ʯī�ų���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com