
| A. | 由途径①和②分别制取1mol FeCl2,理论各消耗1mol Fe,各转移2mol e- | |
| B. | 由途径③和④分别制取1mol Na2SO4,理论各消耗1mol Cl2,各转移2mol e- | |
| C. | 由途径⑤和⑥分别制取1mol H2SO4,理论各消耗1mol S,各转移6 mol e- | |
| D. | 以上说法都不正确 |
分析 根据Fe元素守恒计算途径①、②中消耗Fe的物质的量,途径①中Fe元素化合价由0价升高为+2价,途径②中,制取1mol FeCl2需要制取$\frac{2}{3}$mol FeCl3,前后两个过程转移电子之和为整个过程转移电子;
根据S元素化合价变化计算途径③中转移电子物质的量,根据电子转移守恒计算途径③中消耗氯气物质的量,途径④中根据电子转移守恒计算需要NaClO物质的量,由Cl2+2NaOH=NaCl+NaClO+H2O计算消耗氯气为1mol,前后两个过程转移电子之和为整个过程转移电子;
途径⑤和⑥中整个过程中S元素化合价由0价升高为硫酸中+6价,根据S元素守恒计算消耗S的物质的量,结合S元素化合价变价计算转移电子.
解答 解:A.根据Fe元素守恒,可知消耗Fe的物质的量,途径①、②中制取1mol FeCl2均需消耗1mol Fe.途径①中Fe元素化合价由0价升高为+2价,制取1mol FeCl2,转移电子为2mol,而途径②中,制取1mol FeCl2需要制取$\frac{2}{3}$mol FeCl3,转移电子为$\frac{2}{3}$mol×1,转移电子为(2+$\frac{2}{3}$)mol,故A错误;
B.制取1mol Na2SO4途径③、④均需要Na2SO3,途径③中转移电子为1mol×(6-4)=2mol,根据电子转移守恒消耗氯气为$\frac{2mol}{2}$=1mol.根据电子转移守恒可知途径④中需要NaClO为$\frac{1mol×(6-4)}{1-(-1)}$=1mol,由Cl2+2NaOH=NaCl+NaClO+H2O可知消耗氯气为1mol,转移电子为1mol,故途径④中转移电子总共为3mol,故B错误;
C.途径⑤和⑥中整个过程中S元素化合价由0价升高为硫酸中+6价,制取1mol H2SO4,由硫元素守恒开始消耗S均为1mol,两途径中转移电子均为1mol×(6-0)=6mol,故C正确;
D.由上述发生可知,C选项正确,故D错误,
故选:C.
点评 本题考查氧化还原反应计算,整个过程比较复杂,计算量比较大,属于易错题目,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 | |
| B. | 给试管里的液体加热时,试管应与桌面垂直 | |
| C. | 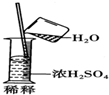 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 试剂及方法 |
| 证明地瓜中有淀粉 | B |
| 除去CO2中混有的少量CO | D |
| 检验FeCl2溶液是否变质 | C |
| 除去Na2CO3固体中NaHCO3 | A |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子之间氢键的方向性导致冰中水分子的堆积方式不属于分子密堆积 | |
| B. | 由极性键构成的分子可能是非极性分子 | |
| C. | 水蒸气、水、冰中都含氢键 | |
| D. | 分子晶体中一定存在分子间作用力,可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质中仅含C、H、O、N四种元素 | |
| B. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| C. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| D. | 鸡蛋清加入食盐,会使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和四氯化碳形成的溶液可以用蒸馏的方法来分离 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com