
【题目】ag纯净的碳酸钠和ag碳酸钠与碳酸氢钠的混合物相比,下列描述正确的是( )
A.分别和盐酸反应时,混合物的耗酸量大
B.分别和足量盐酸反应时,混合物放出的CO2多
C.分别配制成等体积溶液,混合物碱性大
D.分别配制成等体积溶液,混合物的Na+的物质的量大
【答案】B
【解析】
ag碳酸钠的物质的量为![]() mol,ag碳酸氢钠的物质的量在
mol,ag碳酸氢钠的物质的量在![]() mol和
mol和![]() mol之间,就此代入方程式进行计算比较。
mol之间,就此代入方程式进行计算比较。
A. ag碳酸钠和盐酸反应消耗酸为![]() mol, ag碳酸钠与碳酸氢钠的混合物与盐酸反应,消耗酸的物质的量介于
mol, ag碳酸钠与碳酸氢钠的混合物与盐酸反应,消耗酸的物质的量介于![]() mol和
mol和![]() mol之间,因此,碳酸钠消耗的盐酸多,A项错误;
mol之间,因此,碳酸钠消耗的盐酸多,A项错误;
B. ag碳酸钠和盐酸反应生成CO2 ![]() mol,ag碳酸钠与碳酸氢钠的混合物与盐酸反应,生成CO2介于
mol,ag碳酸钠与碳酸氢钠的混合物与盐酸反应,生成CO2介于![]() mol和
mol和![]() mol之间,混合物放出的CO2多,B项正确;
mol之间,混合物放出的CO2多,B项正确;
C. 等浓度的碳酸钠的pH大于碳酸氢钠,因此混合物的碱性小,C项错误;
D. a g纯净的碳酸钠含Na+的物质的量为![]() mol,a g碳酸钠与碳酸氢钠的混合物含Na+的物质的量在
mol,a g碳酸钠与碳酸氢钠的混合物含Na+的物质的量在![]() mol和
mol和![]() mol之间,因此碳酸钠含Na+的物质的量多,D项错误;
mol之间,因此碳酸钠含Na+的物质的量多,D项错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物命名不正确的是
A. ![]() 对二甲苯
对二甲苯
B. 2,3-二甲基-3-乙基戊烷
C. ![]() 异丁烯
异丁烯
D. (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
①写出该反应的平衡常数表达式:K=____________。
②1000s内N2O5的分解速率为:_____________。
③若每有1 mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式____。
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
a.及时分离出N2O5 b.适当提高温度 c.增大O2浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.1mol·L-1的CH3COOH溶液中逐滴加入0.1mol·L-1的NaOH溶液,所得溶液的pH随加入NaOH溶液的体积V的关系中不正确的是
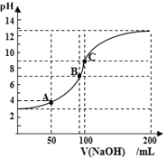
A. A点表示的溶液:c(CH3COO-)>c(Na+)
B. A点溶液中:c(CH3COO-)-c(CH3COOH) =2×(10-4-10-10)mol·L-1
C. B点表示CH3COOH和NaOH恰好反应完全
D. C点溶液促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等)。
(1)Ti2+的基态价电子排布式为_______________________。
(2)甲醛分子中C原子轨道杂化类型为____________。1mol甲醛分子中含有σ键的数目为___________。
(3)甲醛易溶于水,除因为它们都是极性分子外,还因为_______________________。
(4)与N2O互为等电子体的一种分子为________________________(填化学式) 。
(5)某含钛化合物晶胞结构如图所示,该化合物的化学式为_____________________。
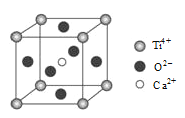
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00 mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000 molL-1的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
NaOH溶液起始读数 | NaOH终点读数 | |
第一次 | 0.10 mL | 12.70 mL |
第二次 | 0.00 mL | 12.40mL |
(1)准确配制0.2000 molL-1的氢氧化钠溶液250 mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的玻璃仪器有____。
(2)根据以上数据可以计算出盐酸的物质的量浓度为___molL-1。
(3)用0.2000 molL-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视______,直到滴定终点。
(4)达到滴定终点的标志是____。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是____(填“偏高”或“偏低”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在________下能够导电的化合物叫做电解质。电解质溶液之所以能够导电,是由于它们在溶液中发生了_______,产生了__________。电离时生成的_____离子全部是___的化合物叫做酸;生成的______离子全部是_____的化合物叫做碱。酸碱发生中和反应的实质是_____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.常温下,1 mol Fe投入足量浓硫酸,转移电子数为3NA
B.5NH4NO3=2HNO3+4N2↑+9H2O,生成28 g N2时,转移的电子数目为3.75NA
C.1 mol Na2O2与足量CO2充分反应转移的电子数目为2NA
D.1molAl与足量氢氧化钠溶液反应,NaOH得电子数为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:

已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________________。
(3)“还原”时,被Sb还原的物质为_____________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______;所加Na2S也不宜过多,其原因为_____________。
(5)“除砷”时有H3PO3生成,该反应的离子方程式为________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com