
【题目】下图是100 mgCaC2O4· H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识,回答下列各问题:
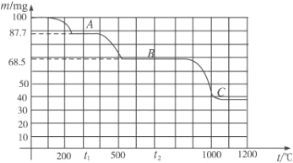
(1)温度分别为t 1 和t 2 时,固体产物的化学式A是______________,B是______________。
(2)由CaC2O4· H2O得到A的化学方程式为__________________________________。
(3)由A得到B的化学方程式为____________________________________________。
(4)由图计算产物C的相对分子质量,并推断C的合理的化学式。
【答案】(1)CaC2O4 CaCO3 (2)CaC2O4·H2O![]() CaC2O4 +H2O↑
CaC2O4 +H2O↑
(3)CaC2O4 ![]() CaCO 3 +CO↑ (4)56 CaO
CaCO 3 +CO↑ (4)56 CaO
【解析】
试题分析:(1)由图可知,t1时A点,100mg CaC2O4·H2O的质量变为87.7mg。CaC2O4·H2O的的摩尔质量是146g/mol,设分解后产物的摩尔质量为M1,则100×10-3/146=87.7×10-3/M 1,解得M1=128.04g/mol;CaC2O4的摩尔质量为128g/mol,因此可推测CaC2O4·H2O的分解反应方程式为CaC2O4·H2O![]() CaC2O4 +H2O↑;A的化学式是CaC 2O4;t2时B点,87.7mg的CaC2O4受热分解,设分解产物的摩尔质量为M 2,则87.7× 10 -3/M1=68.5×10-3/M 2,解得M2=99.98g/mol,因此产物B应为CaCO3;
CaC2O4 +H2O↑;A的化学式是CaC 2O4;t2时B点,87.7mg的CaC2O4受热分解,设分解产物的摩尔质量为M 2,则87.7× 10 -3/M1=68.5×10-3/M 2,解得M2=99.98g/mol,因此产物B应为CaCO3;
(2)根据以上分析可知由CaC2O4· H2O得到A的化学方程式为CaC2O4·H2O![]() CaC2O4 +H2O↑;
CaC2O4 +H2O↑;
(3)根据以上分析可知由A得到B的化学方程式为CaC2O4 ![]() CaCO 3 +CO↑;
CaCO 3 +CO↑;
(4)加热至1000℃~1200℃时,由图可知分解产物C的质量约为38mg,设C点化合物的摩尔质量为M3,则68.5×10-3/M2=38×10-3/M3,解得M3=55.47g/mol;与CaO的摩尔质量(56g/mol)接近,分解方程式应为:CaC2O4![]() CaCO 3 +CO↑,由此得出C的化学式为CaO,其分子量为56。
CaCO 3 +CO↑,由此得出C的化学式为CaO,其分子量为56。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.同系物一定符合同一通式
B.同分异构体一定具有相同的最简式
C.相对分子质量相等的两种有机物必定是同分异构体
D.同分异构体间不一定有相似的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A(C4H8O2)在稀硫酸加热条件下生成B和C,B可催化氧化为D,D可继续催化氧化为C。推断有机物,按要求写出下列反应方程式(请注明反应条件)
(1)A与氢氧化钠溶液的反应
(2)B催化氧化为D的反应
(3)B在浓硫酸170℃加热条件下的反应
(4)D与银氨溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.工业采用火法炼铜:Cu2S+O2=2Cu+SO2 每生成2mol铜,反应共转移4NA个电子
B.7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.1NA
C.CO2通过Na2O2使其增重bg时,反应中转移的电子数为![]()
D.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑
B. 氢氧化镁与稀盐酸反应:OH-+H+=H2O
C. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
D. 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是
A水的电离过程是放热的过程
B水的电离和电解都需要电
C冰熔化成水是一个吸热的过程
D加入电解质一定会破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为:_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是( )
A.0.1mol.L-1.min-1
B.0.2mol.L-1.min-1
C.0.3mol.L-1.min-1
D.0.6mol.L-1.min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com