
【题目】立德粉ZnS·BaSO4 (也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为______(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
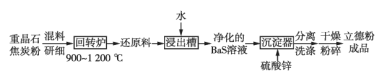
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的______(填化学式)。
③沉淀器中反应的离子方程式为______。
【答案】D BaSO4+4C ![]() BaS+4CO↑ CO+H2O(g)
BaS+4CO↑ CO+H2O(g)![]() CO2+H2 BaCO3 Ba2++S2-+Zn2++SO42-=ZnSBaSO4↓
CO2+H2 BaCO3 Ba2++S2-+Zn2++SO42-=ZnSBaSO4↓
【解析】
(1)Ba元素的焰色为绿色;
(2)重晶石和焦炭混料研细后在回转炉中高温加热得到还原料,在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,则C被氧化生成CO;还原料在浸出槽中加入水过滤得到净化的BaS溶液,滤去未反应的重晶石和C,在沉淀器中加入硫酸锌得到沉淀,然后分离、洗涤、干燥、粉碎得到立德粉ZnSBaSO4(也称锌钡白),
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,同时生成CO;
回转炉尾气中含有有毒气体CO,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,根据元素守恒知清洁能源为氢气;
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,说明有H2S生成,且水溶性变差,说明有难溶性物质生成,硫离子水解生成硫化氢,同时钡离子和二氧化碳、水反应生成碳酸钡沉淀;
③沉淀器中BaS和硫酸锌反应生成沉淀ZnSBaSO4。
(1)Ba元素的焰色为绿色,Na元素焰色为黄色、K元素焰色为紫色、Ca元素焰色为砖红色,故合理选项是D;
(2)重晶石和焦炭混料研细后在回转炉中高温加热得到还原料,在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,则C被氧化生成CO;还原料在浸出槽中加入水过滤得到净化的BaS溶液,滤去未反应的重晶石和C,在沉淀器中加入硫酸锌得到沉淀,然后分离、洗涤、干燥、粉碎得到立德粉ZnSBaSO4(也称锌钡白)。
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,同时生成CO,反应方程式为BaSO4+4C ![]() BaS+4CO↑;
BaS+4CO↑;
回转炉尾气中含有有毒气体CO,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,根据元素守恒知清洁能源为氢气,反应方程式为CO+H2O(g)![]() CO2+H2;
CO2+H2;
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,说明有H2S生成,且水溶性变差,说明有难溶性物质生成,硫离子水解生成硫化氢,同时钡离子和二氧化碳、水反应生成BaCO3沉淀,导致水溶性变差;
③沉淀器中BaS和硫酸锌反应生成沉淀ZnSBaSO4,离子方程式为Ba2++S2-+Zn2++SO42-=ZnSBaSO4↓。


科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素位于短周期内,它们的原子序数依次递增。A原子核内仅有一个质子,B原子的电子总数与D原子最外层电子数相等。D原子最外层电子数是其电子层数的3倍。由此推断:
(1)A与D组成化合物中,含有非极性键的分子的电子式为___________
(2)B与D组成的化合物中,属于非极性分子的电子式为____________
(3)A与C组成的化合物分子式的电子式为____________属于_____分子。(填“极性”或“非极性”)
(4)已知A、B、C、D可组成一种化合物,且原子个数比8 :1 :2 :3该化合物的化学式为_______属于_____化合物(填“离子”或“共价”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是_______________________。
(2)铝与氢氧化钾溶液反应的离子方程式是______________。
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是______________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因______________________。
③除去杂质后的氢氧化钾溶液从液体出口___________(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(![]() )。碘酸钾和碘化钾在溶液中能发生如下反应:
)。碘酸钾和碘化钾在溶液中能发生如下反应:![]() 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )
A.该反应中氧化剂为![]() ,还原剂为
,还原剂为![]()
B.该反应中,每生成3mol![]() 时转移的电子数目为5NA
时转移的电子数目为5NA
C.上述反应中,氧化产物与还原产物的质量之比为1:5
D.直接向食盐中加入淀粉溶液,可以判断该食盐是否为加碘食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物![]() 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的![]() 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和![]() 的阴离子交换柱,使
的阴离子交换柱,使![]() 和
和![]() 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的![]() 用
用![]() 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出![]() 中x的值为_________(取整数)。
中x的值为_________(取整数)。
(2)在实验室中,FeCl2可用铁粉和_________反应制备,FeCl3可用铁粉和_________反应制备。现有一瓶FeCl2溶液,某同学欲检验该溶液是否已经变质,首先取适量溶液于洁净的试管中,然后向溶液中滴加几滴______________,观察溶液是否变成红色即可得出结论。
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:________;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是____________。(填序号)。
A.若无固体剩余,则溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子
四种离子
B.若溶液中有![]() ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应![]() 发生
发生
D.当溶液中有![]() 存在时,则一定没有
存在时,则一定没有![]() 析出
析出
(4)高铁酸钾(![]() )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在![]() 中铁元素的化合价为_________,
中铁元素的化合价为_________,![]() 与
与![]() 在强碱性条件下反应可制取
在强碱性条件下反应可制取![]() ,其反应的离子方程式为________。
,其反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O。下列判断正确的是( )
A. Fe(NO3)x,中的x为![]()
B.反应中每生成0.2 mol还原产物,就有0.6 mol电子转移
C. HNO3在反应中只体现氧化剂
D.磁性氧化铁中的铁元素全部被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是____________________________________。
②试剂a是____________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________。
(3)根据沉淀F的存在,推测![]() 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,![]() 被氧化为
被氧化为![]() 进入D。
进入D。
实验三:探究![]() 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______。
②实验三的结论:__________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和![]() 生成。
生成。
(6)根据上述实验所得结论:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1HNO2溶液的pH=2
A.①②③
B.②③④
C.①④
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A. 1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B. 4.0 mol SO2+1.0 mol O2
C. 2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D. 2.0 mol SO2+0.5 mol O2+1.0 mol SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com