
【题目】将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A. 1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B. 4.0 mol SO2+1.0 mol O2
C. 2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D. 2.0 mol SO2+0.5 mol O2+1.0 mol SO3
【答案】B
【解析】
开始投入2.0mol SO2气体和2.0mol SO3气体,等效为开始投入4.0mol SO2气体和1mol O2气体,在恒温恒容下,平衡时SO3的物质的量为n mol,说明是等效平衡,按化学计量转化到左边,对应成分的物质的量相同,即满足4.0mol SO2气体和1mol O2气体,据此判断。
开始投入2.0mol SO2气体和2.0mol SO3气体,等效为开始投入4.0mol SO2气体和1mol O2气体,在恒温恒容下,平衡时SO3的物质的量为n mol,说明应是完全等效平衡,按化学计量转化到左边,对应成分的物质的量相同,即满足4.0mol SO2气体和1mol O2气体。A、开始为1.6 mol SO2+0.3 mol O2+0.4 mol SO3,转化到左边,由2SO2(g)+O2(g)2SO3(g)可知,n(SO2)=1.6mol+0.4 mol=2mol,n(O2)=0.3mol+![]() ×0.4mol=0.5mol,不满足4.0mol SO2气体和1mol O2气体,故A错误;B、开始为4.0 mol SO2+1.0 mol O2,与原平衡等效,故B正确;C、开始为2.0 mol SO2+1.0 mol O2+2.0 mol SO3,转化到左边,由2SO2(g)+O2(g)2SO3(g)可知,n(SO2)=2mol+2 mol=4mol,n(O2)=1mol+
×0.4mol=0.5mol,不满足4.0mol SO2气体和1mol O2气体,故A错误;B、开始为4.0 mol SO2+1.0 mol O2,与原平衡等效,故B正确;C、开始为2.0 mol SO2+1.0 mol O2+2.0 mol SO3,转化到左边,由2SO2(g)+O2(g)2SO3(g)可知,n(SO2)=2mol+2 mol=4mol,n(O2)=1mol+![]() ×2mol=2mol,不满足4.0molSO2气体和1molO2气体,故C错误;D、开始为3.0 mol SO2+1.0 mol O2+1.0 mol SO3,转化到左边,由2SO2(g)+O2(g)2SO3(g)可知,n(SO2)=3mol+1 mol=4mol,n(O2)=0.5mol+1mol=1.5mol,不满足4.0molSO2气体和1molO2气体,故D错误;故选B。
×2mol=2mol,不满足4.0molSO2气体和1molO2气体,故C错误;D、开始为3.0 mol SO2+1.0 mol O2+1.0 mol SO3,转化到左边,由2SO2(g)+O2(g)2SO3(g)可知,n(SO2)=3mol+1 mol=4mol,n(O2)=0.5mol+1mol=1.5mol,不满足4.0molSO2气体和1molO2气体,故D错误;故选B。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】(6分)某课外活动小组同学用如图装置进行实验,试回答下列问题。

(1)若开始时开关K与b连接,则B极的电极反应式为 。
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
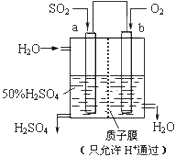
①上述生产硫酸的总反应方程式为____,b是____极(填“正”或“负”),b电极反应式为_____,a电极发生_____。(填“氧化反应”或“还原反应”)
②生产过程中H+向___(填 a 或 b)电极区域运动。
(2)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极,其电极反应式为:_______,该燃料电池总反应式为:_____ ,电池在放电过程中溶液的pH将______(填“下降”或“上升”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个结构简式:CH3—CH3和CH3—,两式中均有短线“—”,这两条短线所表示的意义是
A.都表示一对共用电子对
B.都表示一个共价单键
C.前者表示一对共用电子对,后者表示一个未成对电子
D.前者表示分子内只有一个共价单键,后者表示该基团内无共价单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 分子式为C2H4,可发生以下系列转化,已知B、D是生活中常见的两种有机物,下列说法不正确的是
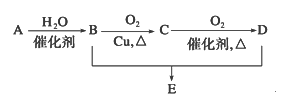
A. 75%的B溶液常用以医疗消毒
B. 由物质A到物质B发生的是加成反应
C. 物质B、D和E可以用饱和Na2CO3溶液鉴别
D. 由物质B、D制备E常用浓硫酸作脱水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+I2(g)![]() 2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
A. 甲、乙提高相同温度
B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强
D. 甲增加0.1molH2,乙增加0.1molI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,求:
(1)该浓硝酸中HNO3的物质的量浓度?
(2)该合金中铜与镁的物质的量之比?
(3)NO2和N2O4的混合气体中,它们的体积分数分别是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14 分) 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。

①A 点时剩余固体的成分是 (填化学式)。B 点时剩余固体的成分是 (填化学式)
②从开始加热到 750K时总反应方程式为 。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com