
【题目】用石墨电极电解CuSO4和KNO3的混合溶液500mL,经一段时间电解后,两极都得到11.2L气体(标准状况),此混合液中Cu2+的物质的量浓度为( )
A.0.5mol/L
B.0.8mol/L
C.1mol/L
D.1.5mol/L
【答案】C
【解析】解:用石墨电极电解1L含CuSO4和KNO3混合溶液,在两极均生成标准状况下的气体11.2L,气体的物质的量为n= ![]() =0.5mol,
=0.5mol,
溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH﹣﹣4e﹣=2H2O+O2↑,生成0.5molO2,需电子为4×0.5mol=2mol;
阴极电极反应为:Cu2++2e﹣=Cu、2H++2e﹣=H2↑,生成0.5molH2,需0.5mol×2=1mol电子,依据电子守恒,铜离子得到电子1mol,反应的铜离子物质的量0.5mol,所以Cu2+的物质的量浓度c= ![]() =1mol/L,
=1mol/L,
故选C.


科目:高中化学 来源: 题型:
【题目】用盐酸作标准液滴定待测浓度的NaOH溶液,若用甲基橙作指示剂,当滴定达终点时,消耗盐酸V1mL;若用酚酞作指示剂,当滴定达终点时,消耗盐酸V2mL;则两种情况下消耗盐酸的体积关系是( )
A. V1>V2 B. V1=V2 C. V1<V2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( )
A.2 mol
B.3 mol
C.4 mol
D.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库。占地球上储量99%的溴分步在海洋中,我国目前是从食盐化工的尾料中提取溴,反应原理是:Cl2+2Br-→2Cl-+Br2。
(1)氯原子最外层电子轨道表示式是______________,氯气属于________分子(填写“极性”或“非极性”)。
(2)已知溴水中存在如下化学平衡:Br2+H2O![]() H++Br-+HBrO。取少量溴水于一支试管中,向试管中滴加氢氧化钠溶液,溶液颜色变浅。请用平衡移动的观点解释颜色变浅的原因_____________。
H++Br-+HBrO。取少量溴水于一支试管中,向试管中滴加氢氧化钠溶液,溶液颜色变浅。请用平衡移动的观点解释颜色变浅的原因_____________。
(3)氟和溴都属于卤族元素,HF和地壳内SiO2存在以下平衡:4HF(g)+ SiO2(s) ![]() SiF4(g)+2H2O(g)+148.9kJ。该反应的平衡常数表达式K=_________________。如果上述反应达到平衡后,降低温度,该反应会_____________(填写“向正反应方向移动”或“向逆反应方向移动”),在平衡移动时逆反应速率先_______后_______(填写“增大”或“减小”)。
SiF4(g)+2H2O(g)+148.9kJ。该反应的平衡常数表达式K=_________________。如果上述反应达到平衡后,降低温度,该反应会_____________(填写“向正反应方向移动”或“向逆反应方向移动”),在平衡移动时逆反应速率先_______后_______(填写“增大”或“减小”)。
(4)若反应的容器容积为2.0 L,反应时间8.0min,容器内气体的质量增加了0.24g,在这段时间内HF的平均反应速率为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。此温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则正、逆反应速率的比较为v正________v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
【答案】A
【解析】A. 据图可知,加入40mLNaHCO3溶液时生成沉淀最多,沉淀为0.032mol,因NaOH过量,则滤液中含有NaOH,由反应顺序OH+HCO3=CO32+H2O、HCO3+AlO2+H2O═Al(OH)3↓+ CO32并结合图象可知,加入前8mLNaHCO3溶液时不生成沉淀,则原NaHCO3溶液中c(NaHCO3)= ![]() =1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
=1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
【题型】单选题
【结束】
8
【题目】芳香化合物在催化剂催化下与卤代烃发生取代反应称为 Friedel- Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(![]() )。反应如下:
)。反应如下:
已知下列信息:

I、如图是实验室制备无水AlCl3的实验装置:

(1)E装置中的仪器名称是____________________。
(2)写出B装置中发生反应的离子方程式:____________________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:__________________ (写导管口标号)。
(4)下列操作正确的是__________________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:____________________________________。
Ⅱ、实验室制取叔丁基苯装置如图:
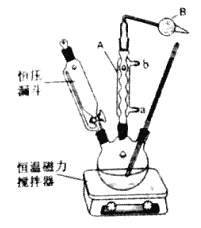
在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是__________________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是__________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为__________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种很重要的清洁能源,其主要成分为CH4 ,下列说法正确的是
A. 常温常压下CH4是液体 B. 一氯甲烷分子式为CH4Cl
C. CH4与Cl2可以发生加成反应 D. CH4完全燃烧生成CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com