
����Ŀ�����Ȼ�����![]() ���������ĵ�������ճ������ڹ�ҵ�Ͼ�����Ҫ��Ӧ�ã�ijʵ�����о�С��ͨ����������������Ӧ��������ϣ���֪��
���������ĵ�������ճ������ڹ�ҵ�Ͼ�����Ҫ��Ӧ�ã�ijʵ�����о�С��ͨ����������������Ӧ��������ϣ���֪��![]() ��������������110~140��ʱ��������Ӧ�õ�����ɫ��
��������������110~140��ʱ��������Ӧ�õ�����ɫ��![]() �ֲ�Ʒ��
�ֲ�Ʒ��
�й����ʵIJ����������±���
���� | ��ۣ������£� | �۵�/�� | �е�/�� | ��ѧ���� |
| ����ɫ���� | 112��8 | 444��6 | �� |
| ����ɫҺ�� |
| 135��6 | ����ˮ���ҷ�Ӧ�����ֻ�ɫ���ǣ����������ִ̼�����ζ������ ������ ���¶ȹ����ֽ⣬300��������ȫ�ֽ� |
| ��ɫҺ�� |
| �� | 59��6�淢����ȫ�ֽ⣬�ֽ����Ϊ |
����Ҫ��������������ҩƷ��ȡ���������������ҽ�һ������Ӧ���Ʊ�![]() ��
��
�ṩ��������
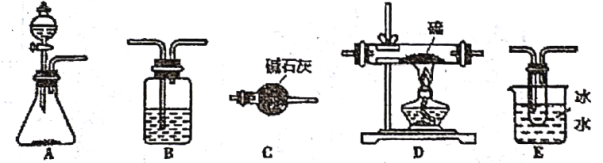
�ṩ��ҩƷ��
Ũ���ᡢŨ![]() ��
��![]() ��
��![]() ������
������![]() ��Һ����ʯ�ҡ���ǡ�
��Һ����ʯ�ҡ���ǡ�![]() ��Һ����ˮ������ʳ��ˮ��
��Һ����ˮ������ʳ��ˮ��
��1������Ҫʹ��װ��A���Ʊ�������д���Ʊ�![]() �����ӷ���ʽ��______
�����ӷ���ʽ��______
��2���������ṩ���������ʵ��װ�ã�д����Ӧ������˳������B��ʹ��2�Σ�______���ڶ���װ��B�е�ҩƷ��______��
��3��![]() �����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ��д�������ʽ_______��
�����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ��д�������ʽ_______��![]() ��ˮ���ҷ�Ӧ�����ֻ�ɫ���ǣ����������ִ̼�����ζ�����壬д����ػ�ѧ����ʽ��______��
��ˮ���ҷ�Ӧ�����ֻ�ɫ���ǣ����������ִ̼�����ζ�����壬д����ػ�ѧ����ʽ��______��
��4��װ��C��������______��
��5��ʵ���������Ҫ����װ��D�ļ����¶ȣ�������Ҫ���ƺ�![]() ��ͨ������ԭ����?______��
��ͨ������ԭ����?______��
��6��װ��E���ռ����Ĵֲ�Ʒ![]() �ʵ���ɫ����ν�һ���ᴿ?______��
�ʵ���ɫ����ν�һ���ᴿ?______��
���𰸡�![]()
![]() Ũ
Ũ![]()
![]()
![]() ��ȥʣ���
��ȥʣ���![]() ����ֹ�����е�ˮ��������װ��D ��ֹ�¶ȹ���ʹ
����ֹ�����е�ˮ��������װ��D ��ֹ�¶ȹ���ʹ![]() �ֽ⣬��ֹ
�ֽ⣬��ֹ![]() �����
�����![]() ��Ӧ����
��Ӧ����![]() ��Ӱ����� �Դֲ�Ʒ����60-70��ˮԡ����
��Ӱ����� �Դֲ�Ʒ����60-70��ˮԡ����
��������
��1���ڲ����ȵ�����£�Ҫʹ��װ��A���Ʊ��������õ��ķ�Ӧ����Ũ���������أ������Ȼ��ء�������ˮ��
��2�����ݱ�ʵ���Ҫ���ø����������������Ӧ��ȡS2Cl2,��Ϊ����S2Cl2��Ӧѡ���ˮ��ȴ������Ϊ��ֹ��Ⱦ�����Ϳ����е�ˮ��������D����װ�����Ҫ�ü�ʯ�ҵĸ���ܽ���Ϳ���������
��3��S2Cl2�����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ��������ʽ��ʽдҪ����д����ʽ���������֪��S2Cl2��ˮ��Ӧ���ɵ���ɫ�����д̼�����ζ�Ķ���������Ȼ��⣻
��4��װ��CΪװ�м�ʯ�ҵĸ���ܣ��������ǣ���ȥʣ���Cl2����ֹ�����е�ˮ��������װ��D��
��5����Ϊ�¶ȹ���ʹS2Cl2��ֽ⣬����ʵ���������Ҫ�����¶ȣ�������������S2Cl2��Ӧ����SCl2��Ӱ����ʣ�����Ҫ���ƺ�Cl2��ͨ������
��6���ֲ�Ʒ�к���SCl2,�������ܷе��������60-70��ˮԡ���ȣ�ʹSCl2�ӷ���
��1��Ҫʹ��װ��A�ڲ����ȵ�������Ʊ��������õ��ķ�Ӧ����Ũ���������أ������Ȼ��ء�������ˮ�����ӷ���ʽΪ��CLO3-![]() 5Cl-
5Cl-![]() 6H+=3Cl2
6H+=3Cl2![]() 3H2O��
3H2O��
�������CLO3-![]() 5Cl-
5Cl-![]() 6H+=3Cl2
6H+=3Cl2![]() 3H2O��
3H2O��
��2�����ݱ�ʵ���Ҫ���ø����������������Ӧ��ȡS2Cl2,��Ϊ����S2Cl2��Ӧѡ���ˮ��ȴ������Ϊ��ֹ��Ⱦ�����Ϳ����е�ˮ��������D����װ�����Ҫ�ü�ʯ�ҵĸ���ܽ������������������װ�õ�˳��Ϊ��A![]() B
B![]() B
B![]() D
D![]() E
E![]() C���ڶ�����Ũ�����ȥCl2�е�ˮ������
C���ڶ�����Ũ�����ȥCl2�е�ˮ������
�������A![]() B
B![]() B
B![]() D
D![]() E
E![]() C��Ũ���ᡣ
C��Ũ���ᡣ
��3��S2Cl2�����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ�������ʽΪ��![]() ���������֪��S2Cl2��ˮ��Ӧ���ɵ���ɫ�����д̼�����ζ�Ķ���������Ȼ��⣬��ѧ����ʽΪ��2S2Cl2
���������֪��S2Cl2��ˮ��Ӧ���ɵ���ɫ�����д̼�����ζ�Ķ���������Ȼ��⣬��ѧ����ʽΪ��2S2Cl2![]() 2H2O=3S
2H2O=3S![]() SO2
SO2![]() 4HCl
4HCl![]() ��
��
�������![]() ��2S2Cl2
��2S2Cl2![]() 2H2O=3S
2H2O=3S![]() SO2
SO2![]() 4HCl
4HCl![]() ��
��
��4��װ��CΪװ�м�ʯ�ҵĸ���ܣ��������ǣ���ȥʣ���Cl2����ֹ�����е�ˮ��������װ��D��
�����Ϊ����ȥʣ���Cl2����ֹ�����е�ˮ��������װ��D��
��5����Ϊ�¶ȹ���ʹS2Cl2��ֽ⣬����ʵ���������Ҫ�����¶ȣ�������������S2Cl2��Ӧ����SCl2��Ӱ����ʣ�����Ҫ���ƺ�Cl2��ͨ������
�����Ϊ����ֹ�¶ȹ���ʹS2Cl2�ֽ⣬��ֹS2Cl2�����Cl2��Ӧ����S2Cl2Ӱ����ʡ�
��6���ֲ�Ʒ�к���SCl2,�������ܷе��������60-70��ˮԡ���ȣ�ʹSCl2�ӷ���
�����Ϊ���Դֲ�Ʒ����60-70��ˮԡ���ȡ�
2


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
A. ��2H2��g����O2��g����2H2O��g����H��-483��6kJ��mol��1����H2ȼ����Ϊ241��8kJ��mol��1
B. ��C��ʯī��s����C�����ʯ��s����H>0����ʯī�Ƚ��ʯ�ȶ�
C. ��֪NaOH��aq����HCl��aq����NaCl��aq����H2O��l����H��-57��4kJ��mol��1����20��0gNaOH������ϡ������ȫ�кͣ��ų�28��7kJ������
D. ��֪2C��s����2O2��g����2CO2��g����H1��2C��s����O2��g����2CO��g����H2������H1>��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ܶ����嶼����������Ȫʵ�飬����ͬ��ͬѹ�������������ƿ��һ���ռ���![]() ��
��![]() �Ļ�����壬��һ���ռ���
�Ļ�����壬��һ���ռ���![]() ����ͼ��ʾ����Ȫʵ��ֹͣ��������ƿ����Һ�����ʵ����ʵ���Ũ�ȣ�
����ͼ��ʾ����Ȫʵ��ֹͣ��������ƿ����Һ�����ʵ����ʵ���Ũ�ȣ�![]() �������ʵ�����������
�������ʵ�����������![]() ����ϵ�ǣ�����ƿ������Һ�ܶȼ�����ȣ�
����ϵ�ǣ�����ƿ������Һ�ܶȼ�����ȣ�
A. ![]() ��
��![]() ����ͬ B.
����ͬ B. ![]() ��
��![]() ����ͬ
����ͬ
C. ![]() ��ͬ��
��ͬ��![]() ��ͬ D.
��ͬ D. ![]() ��ͬ��
��ͬ��![]() ��ͬ
��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г�������֮���һЩ��Ӧ��ϵ�����в��ֲ���δд����������X�ǹ��壬B��G��Һ�壬�����Ϊ���塣������ͼ��ϵ�ƶϣ�

(1)д����ѧʽ��X_______��A________��B_______��
(2)ʵ�����ռ�����D��F�ķ���������_______����________����
(3)д��C��E�Ļ�ѧ����ʽ��____________��
(4)��д��A��E��Ӧ����D�Ļ�ѧ����ʽ��_______________
(5)��������A�ķ�����������________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ�����������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬���ų��������õ�![]()
![]() ����Һ��Ȼ����
����Һ��Ȼ����![]() ������ζ���������ɳ�������������������������ϵ��ͼ��ʾ��������˵������ȷ����
������ζ���������ɳ�������������������������ϵ��ͼ��ʾ��������˵������ȷ����
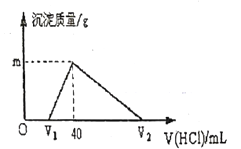
A. ԭ�Ͻ�����Ϊ![]()
B. �������������Ϊ![]() ����״���£�
����״���£�
C. ͼ��![]() ��ֵΪ1��56
��ֵΪ1��56
D. ͼ��![]() Ϊ100
Ϊ100
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ȱ�������ͬ���칹�壬�����屽����ͬ���칹��
A.1��B.2��C.3��D.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ʷ�����ǣ�������
A.©��B.������ƿC.��Һ©��D.����ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯����������ͼ��ʾ����������ȷ����

A. ��Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ0.158 mol/(Ls)
B. ��Ӧ��ʼ��10s��X�����ʵ���Ũ�ȼ�����0.79 mol/L
C. ��Ӧ��ʼ��10s��Y��ת����Ϊ79.0 %
D. ��Ӧ�Ļ�ѧ����ʽΪ��X��Y![]() Z
Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ���������ܱ������з������·�Ӧ��xA(g)+yB(g)![]() zC(g)���ﵽƽ�����A�����Ũ��Ϊ0.5 mol��L��1�������¶Ȳ��䣬���ܱ��������ݻ�ѹ��Ϊԭ����һ���ٴδﵽƽ����AŨ��Ϊ0.8 mol��L��1��������������ȷ���ǣ� ��
zC(g)���ﵽƽ�����A�����Ũ��Ϊ0.5 mol��L��1�������¶Ȳ��䣬���ܱ��������ݻ�ѹ��Ϊԭ����һ���ٴδﵽƽ����AŨ��Ϊ0.8 mol��L��1��������������ȷ���ǣ� ��
A��ƽ��������Ӧ�����ƶ� B��x+y��z
C��B�����ʵ���Ũ�ȼ�С D��C�������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com