
【题目】(题文)(2018·天津市南开中学第五次月考)Ⅰ.对有机物X 的组成结构、性质进行观察、分析,得到实验结果如下:
①X为无色晶体,微溶于水,易溶于Na2CO3溶液;
②完全燃烧166 mg有机物X,得到352 mg CO2和54mg H2O;
③X分子中只有2 种不同结构位置的氢原子;
④X的相对分子质量在100~200之间。
根据以上信息回答下列问题:
(1)X的分子式为_____________,结构简式为_________________________。
(2)X的一种同分异构体(与X具有相同的官能团),在一定条件下可发生分子内脱水反应生成一种含有五元环的有机物Y,Y的结构简式为______________________。
(3)X的某些同分异构体具有如下性质:
a.能发生水解反应 b.能发生银镜反应 c.能使氯化铁溶液显紫色。
请写出可能的结构简式_______________________________(任写两种)。
Ⅱ.工业上以丁二烯(CH2=CH-CH=CH2)为原料合成丁烯二酸(HOOC-CH=CH-COOH)的合成路线如图所示:

请回答下列问题:
(4)写出反应类型:①_______________,②_______________。
(5)写出反应②⑤的化学方程式(注明反应条件):
②______________________________________;
⑤_______________________________________。
(6)在上述合成路线中,有同学提议略去③④⑤⑥反应,由HOCH2CH=CHCH2OH直接氧化制得丁烯二酸而使合成步骤简化,请你评价该建议是否合理? 并写出你的理由。______________________________。
【答案】 C8H6O4 ![]()

![]() 、
、 加成反应 取代反应 BrCH2CH=CHCH2Br +2NaOH
加成反应 取代反应 BrCH2CH=CHCH2Br +2NaOH![]() HOCH2CH=CHCH2OH+2NaBr HOOCCH2CHClCOOH+3NaOH
HOCH2CH=CHCH2OH+2NaBr HOOCCH2CHClCOOH+3NaOH![]() NaOOCCH=CHCOONa+NaCl+3H2O 不合理,因为碳碳双键可能同时被氧化
NaOOCCH=CHCOONa+NaCl+3H2O 不合理,因为碳碳双键可能同时被氧化
【解析】Ⅰ.试题分析:①X为无色晶体,微溶于水,易溶于Na2CO3溶液,则X可能为有机酸;②完全燃烧166 mg有机物X,得到352 mg CO2和54mg H2O,则X分子中C、H、O的原子个数比为![]() ,则X的实验式为C4H3O2;③X分子中只有2 种不同结构位置的氢原子,一种与碳原子成键,另一种与氧原子成键;④X的相对分子质量在100~200之间,则100<n(
,则X的实验式为C4H3O2;③X分子中只有2 种不同结构位置的氢原子,一种与碳原子成键,另一种与氧原子成键;④X的相对分子质量在100~200之间,则100<n(![]() )<200,解之得n=2,所以,X的分子式为C8H6O4,X为对苯二甲酸。
)<200,解之得n=2,所以,X的分子式为C8H6O4,X为对苯二甲酸。
(1)X的分子式为C8H6O4,结构简式为![]() 。
。
(2)X的一种同分异构体(与X具有相同的官能团),在一定条件下可发生分子内脱水反应生成一种含有五元环的有机物Y,则X的同分异构体为邻苯二甲酸、Y为邻苯二甲酸酐,其结构简式为 。
。
(3)X的某些同分异构体具有如下性质:a.能发生水解反应,则其分子中有酯基;b.能发生银镜反应,则其分子中有醛基;c.能使氯化铁溶液显紫色,则其分子中有酚羟基。其可能的结构有![]() 或
或 等。
等。
Ⅱ.工业上以丁二烯(CH2=CH-CH=CH2)为原料合成丁烯二酸(HOOC-CH=CH-COOH)的合成路线如图所示:

试题分析:由以上合成路线可知,丁二烯与溴发生1,4-加成反应生成A,A为1,4-二溴-2-丁烯;A发生水解反应生成![]() ,
,![]() 与HCl发生加成反应生成
与HCl发生加成反应生成![]() ,
,![]() 发生氧化反应生成HOOCCH2CHClCOOH,HOOCCH2CHClCOOH发生消去反应生成B,B为NaOOCCH=CHCOONa,最后,NaOOCCH=CHCOONa酸化生成HOOCCH=CHCOOH。
发生氧化反应生成HOOCCH2CHClCOOH,HOOCCH2CHClCOOH发生消去反应生成B,B为NaOOCCH=CHCOONa,最后,NaOOCCH=CHCOONa酸化生成HOOCCH=CHCOOH。
(4)反应类型:①加成反应,②取代反应。
(5
②BrCH2CH=CHCH2Br +2NaOH![]() HOCH2CH=CHCH2OH+2NaBr;
HOCH2CH=CHCH2OH+2NaBr;
⑤HOOCCH2CHClCOOH+3NaOH![]() NaOOCCH=CHCOONa+NaCl+3H2O。
NaOOCCH=CHCOONa+NaCl+3H2O。
(6)在上述合成路线中,有同学提议略去③④⑤⑥反应,由HOCH2CH=CHCH2OH直接氧化制得丁烯二酸而使合成步骤简化,这种说法不合理,因为碳碳双键可能同时被氧化。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O![]() +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=________。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1mol甲醇中含有C—H键的数目为4NA
B. 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C. 标准状况下,2.24L已烷含有分子的数目为0.1NA
D. 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E 同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为___________________。
(2)EAB2D4水溶液显酸性的原因是________________________________________。
(3)等浓度的EABD3和E2BD3混合溶液中,各离子的离子浓度由大到小的顺序为________________。
(4)A、B、D、E 四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2 溶液反应的离子方程式____________________________________________。
(5)常温下,测得X 和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2 (g ) 2CA3(g) ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为C2 0.5mol、A2 0.2mol、CA3 0.2 mol,此时容器体积为1.0 L。
①实验室制备CA3的的化学方程式____________________________。
②如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将__________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)大气污染物成分中属于酸性氧化物的是_______________________(填化学式)。
(2)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3。已知H2SO3是二元弱酸,写出反应的离子方程式:
①NaOH溶液吸收过量的SO2:_____________________________________________。
②氨水吸收过量的SO2:___________________________________________________。
(3)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2
2CO2+N2
①该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式)。
②当生成2mol N2时,转移电子的物质的量是___________________________。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,生成的产物都无毒。NH3还原NO2时,还原剂和氧化剂的物质的量之比是________________。
(5)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是____。
(6)SO2通过下列过程既能制得H2SO4又能制得H2。

①可循环利用的物质X是_________________(填化学式)。
②制得H2SO4的化学方程式是____________________________________。
③制得H2的化学方程式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
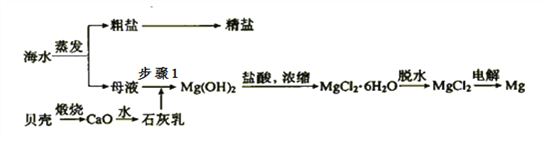
Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是 ______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Na2CO3溶液
加入试剂的顺序是_____________;
II.实验室利用精盐配制480mL 2.0mol·L1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是(_________)
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com