
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E 同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为___________________。
(2)EAB2D4水溶液显酸性的原因是________________________________________。
(3)等浓度的EABD3和E2BD3混合溶液中,各离子的离子浓度由大到小的顺序为________________。
(4)A、B、D、E 四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2 溶液反应的离子方程式____________________________________________。
(5)常温下,测得X 和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2 (g ) 2CA3(g) ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为C2 0.5mol、A2 0.2mol、CA3 0.2 mol,此时容器体积为1.0 L。
①实验室制备CA3的的化学方程式____________________________。
②如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将__________移动(填“正向”、“逆向”或“不”)。
【答案】 ![]() 草酸氢根离子的水解程度小于其电离程度 (Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) Ba2++ HCO3-+ OH-= BaCO3↓+H2O 10-4: 1或1: 104 2NH4Cl+Ca(OH)2
草酸氢根离子的水解程度小于其电离程度 (Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) Ba2++ HCO3-+ OH-= BaCO3↓+H2O 10-4: 1或1: 104 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 逆向
CaCl2+2H2O+2NH3↑ 逆向
【解析】试题分析:A、B、C、D、E五种短周期元素,原子序数依次增大,A、E 同主族,A元素的原子半径最小,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素;C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,则C为氮元素,X为硝酸、Y为氯化铵;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源,则D为氧元素、E为钠元素。
(1)CO2的电子式为![]() 。
。
(2)H2C2O4是二元弱酸,HC2O4-既能电离又能水解,NaHC2O4水溶液显酸性的原因是:草酸氢根离子的水解程度小于其电离程度。
(3)等浓度的NaHCO3和Na2CO3混合溶液中,由于CO32-的水解程度大于HCO3-的水解程度、溶液显碱性,故各离子的离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
(4)H、C、O、Na 四种元素组成的某无机化合物,受热易分解,则该物质为碳酸氢钠。该化合物的溶液与足量的Ba(OH)2 溶液反应的离子方程式为Ba2++ HCO3-+ OH-= BaCO3↓+H2O。
(5)常温下,测得硝酸和氯化铵的水溶液的pH均为5,硝酸抑制水的电离而氯化铵水解促进水的电离,则硝酸中水电离的H+浓度等于c(OH-)=![]() ,氯化铵中水电离的H+浓度等于c(H+)=
,氯化铵中水电离的H+浓度等于c(H+)=![]() ,所以,两种水溶液中由水电离出的H+浓度之比是10-4: 1(或1: 104)。
,所以,两种水溶液中由水电离出的H+浓度之比是10-4: 1(或1: 104)。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:N2(g)+3H2 (g) 2NH3(g) ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为N2 0.5mol、H2 0.2mol、NH3 0.2 mol,气体的总物质的量为0.9mol,此时容器体积为1.0 L,平衡常数K=![]() 。
。
①实验室制备NH3的的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
②如果保持温度和压强不变,向上述平衡体系中加入0.18mol N2,若平衡不移动,则气体的总物质的量变为(0.9mol+0.18mol)=1.08mol,容器的体积变为![]() ,Qc=
,Qc=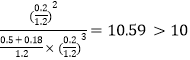 ,则平衡将逆向移动。
,则平衡将逆向移动。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于某物质是否为电解质的判断正确的是( )
A.固体氯化钠不导电,所以氯化钠不是电解质
B.氯化氢水溶液能导电,所以氯化氢是电解质
C.SO2溶于水能导电,所以SO2是电解质
D.氨水能导电,所以氨水是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
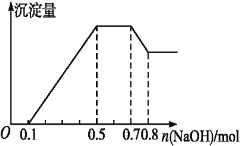
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种安全、高效的消毒剂,实验室制取二氧化氯的化学方程式如下:2NaClO3 + Na2SO3 + H2SO4 ![]() 2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
A. NaClO3是还原剂 B. Na2SO3被氧化
C. NaClO3失去电子 D. H2SO4发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(2018·天津市南开中学第五次月考)Ⅰ.对有机物X 的组成结构、性质进行观察、分析,得到实验结果如下:
①X为无色晶体,微溶于水,易溶于Na2CO3溶液;
②完全燃烧166 mg有机物X,得到352 mg CO2和54mg H2O;
③X分子中只有2 种不同结构位置的氢原子;
④X的相对分子质量在100~200之间。
根据以上信息回答下列问题:
(1)X的分子式为_____________,结构简式为_________________________。
(2)X的一种同分异构体(与X具有相同的官能团),在一定条件下可发生分子内脱水反应生成一种含有五元环的有机物Y,Y的结构简式为______________________。
(3)X的某些同分异构体具有如下性质:
a.能发生水解反应 b.能发生银镜反应 c.能使氯化铁溶液显紫色。
请写出可能的结构简式_______________________________(任写两种)。
Ⅱ.工业上以丁二烯(CH2=CH-CH=CH2)为原料合成丁烯二酸(HOOC-CH=CH-COOH)的合成路线如图所示:

请回答下列问题:
(4)写出反应类型:①_______________,②_______________。
(5)写出反应②⑤的化学方程式(注明反应条件):
②______________________________________;
⑤_______________________________________。
(6)在上述合成路线中,有同学提议略去③④⑤⑥反应,由HOCH2CH=CHCH2OH直接氧化制得丁烯二酸而使合成步骤简化,请你评价该建议是否合理? 并写出你的理由。______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A.容器内气体密度不随时间变化
B.v (X): v (Y)= l:2
C.容器内X、Y、Z的浓度不随时间变化
D.单位时间消耗0.1 molX同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,必须由给出的物质与某种氧化剂发生反应才可实现的是( )
A.NH3→NO
B.Fe3+→Fe2+
C.Cl2→NaClO
D.NO2→HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com