
����Ŀ����.��ҵ�Ͽ���CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�������ʾ��
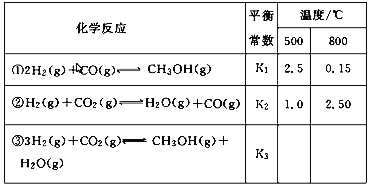
��1���ݷ�Ӧ���������Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��_______����K1��K2��ʾ����
��2��500 ��ʱ��÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O��g����Ũ�ȣ�mol��L��1���ֱ�Ϊ0.8��0.1��0.3��0.15�����ʱv��________v��������>��������������<������
��.����CO��H2���Ժϳɼ״�����Ӧԭ��ΪCO��g����2H2��g��![]() CH3OH��g����һ�������£����ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3OH��g����һ�������£����ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
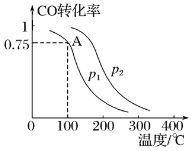
��1��p1___p2������>������<��������������������_______________��
��2���ü״��ϳɷ�Ӧ��A���ƽ�ⳣ��K��_________����a��V��ʾ����
��3���÷�Ӧ�ﵽƽ��ʱ����Ӧ��ת���ʵĹ�ϵ��CO_____H2������>������<��������������
��4�����д�ʩ���ܹ�ͬʱ��������Ӧ���ʺ����COת���ʵ���________������ĸ����
A��ʹ�ø�Ч���� B�����ͷ�Ӧ�¶�
C��������ϵѹǿ D�����Ͻ�CH3OH�ӷ�Ӧ������з������
���𰸡�K1K2 > < ��ͬ�¶��£�P1ѹǿ��CO��ת���ʱ�P2ѹǿ��CO��ת���ʵ� ![]() �� C
�� C
��������
��.��1�����ݸ�˹���ɣ�������ʽ��+�ٵ÷���ʽ�ۣ���ƽ�ⳣ��K3= K1K2��
��2������¶ȱ仯���������¶����ߣ�ƽ�ⳣ����С��ƽ��������У������жϷ�Ӧ�Ƿ��ȷ�Ӧ���ʱ���H<0����500�桢2L���ܱ������У����з�Ӧ�ۣ���÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O ��g����Ũ�ȣ�mol/L���ֱ�Ϊ0.8��0.1��0.3��0.15��Q=![]() =0.87<K=2.5����Ӧ������У�v��>v����
=0.87<K=2.5����Ӧ������У�v��>v����
��. (1)�״��ĺϳɷ�Ӧ�Ƿ��������ٵķ�Ӧ����ͬ�¶���,����ѹǿ,ƽ��������Ӧ�����ƶ�����CO��ת����������ͼ��֪��P1<p2���ʴ�Ϊ: < ���״��ĺϳɷ�Ӧ�Ƿ��������ٵķ�Ӧ,��ͬ�¶���,����ѹǿCO��ת������ߣ�
(2)����ͼ��֪����A��, CO��ת����Ϊ0.75 ,����ƽ��ʱn(CO)=amol��(1-0.75) =0.25amol , n(CH3OH) =c(CO) (�μӷ�Ӧ) =amol��0.5=0.75amol, n(H2) =2amol-2��amol��0.75=0.5amol ,��c(CO)=![]() mol/L��c(CH3OH) =
mol/L��c(CH3OH) = ![]() mol/L��c(H2)=
mol/L��c(H2)=![]() mol/L ,����K=
mol/L ,����K= =
=![]() ��
��
(3)��Ӧ�������֮�ȵ��ڷ�Ӧ����ʽ�е�ϵ��֮�ȣ������ַ�Ӧ��ת������ȣ��÷�Ӧ�з�Ӧ��CO��H2��ϵ��֮��Ϊ1 : 2 ������Ͷ�������֮�ȣ�����CO��H2��ת������ȣ�
(4)A��ʹ�ø�Ч��������Ӧ���ʼӿ�,��ƽ�ⲻ�ƶ���ѡ��A��ѡ��
B�����ͷ�Ӧ�¶ȣ���Ӧ���ʼ�����ѡ��B��ѡ��
C��������ϵѹǿ����Ӧ���ʼӿ죬ƽ�������ƶ��� CO��ת��������ѡ��Cѡ��
D�����Ͻ�CH3OH�ӷ�Ӧ������з����������Ӧ���ʼ�����ѡ��D��ѡ��
��ѡC��


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. ��״���£�22.4 L�����к���2NA������
B. 0.1NA���Ȼ������ռ�����Ϊ2.24 L
C. 2�˽����Ʊ�ɸ�����ʱʧȥ�ĵ�����Ϊ0.1NA
D. 50 mL 0.1 mol��L-1H2SO4��Һ�к���H+��Ϊ0.005NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaNO2 ����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪ NaNO2�ܷ�����Ӧ��2NaNO2��4HI===2NO����I2��2NaI��2H2O��
(1)������Ӧ���������� ________�����ѧʽ��
(2)����������Ӧ������ NaNO2 �� NaCl����ѡ�õ������� ��ˮ���ڵ⻯��������ֽ�۵��ۡ��ܰơ���ʳ�ף�����Ϊ����ѡ�õ�������________(�����)��
(3)����ƽ���»�ѧ����ʽ��____Al��____NaNO3��____ NaOH= ____NaAlO2��____ N2����___H2O
����Ӧ������ת�� 5 mol ���ӣ������ɱ�״���� N2 �����Ϊ_________L��
�������ǻ������������ֺ������绢���������������ִ���ҵ��ζ����������ϡ�����ȶ��ģ������������ܽ���Ũ���������� VO2����
(4)V2O5 �������������ǿ�Ӧ���ɷ�����(������Ϊ VO43��)������ǿ�����ɺ���������(VO2��)���Ρ���д�� V2O5 �ֱ����ռ���Һ��ϡ���ᷴӦ���ɵ��εĻ�ѧʽ��_______��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH2C2O4����һ�ֶ�Ԫ���ᣬ�㷺�ֲ��ڶ�ֲ�����С�
��1�������ڲ����ۻ������ǵ��½�ʯ����Ҫ�ɷ��Dz���ƣ��γɵ�ԭ��֮һ�����о����֣�EDTA��һ���ܽ�Ͻ������ӵ��Լ�����һ�������¿�����Ч�ܽ��ʯ���û�ѧƽ��ԭ��������ԭ��_______________��
��2����֪��0.1 mol��L��1KHC2O4��Һ�����ԡ�����˵����ȷ����_______������ĸ��ţ���
a. 0.1 mol��L��1KHC2O4��Һ�У�c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol��L��1KHC2O4��Һ�У�c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. Ũ�Ⱦ�Ϊ0.1 mol��L��1KHC2O4��K2C2O4�Ļ����Һ�У�2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4��Һ�еμӵ�Ũ��NaOH��Һ�����ԣ�c(K+) > c(Na+)
��3�����ò����Ʊ�������������(FeC2O4��xH2O)�����̼���ֲⶨ�������£�
![]()
��֪��i. pH>4ʱ��Fe2+�ױ���������
ii. �������ʵ��ܽ��(g /100g H2O)����
FeSO4��7H2O | (NH4)2SO4 | FeSO4��(NH4)2SO4��6H2O | |
20�� | 48 | 75 | 37 |
60�� | 101 | 88 | 38 |
����ϡ�������ҺpH��1��2��Ŀ���ǣ�_____________��______________��
�����ȹ��˵�ԭ���ǣ�_______________��
��������ԭ�ζ��������ڲⶨ�������������Ħ������(M)����ȡa g����������������ϡ�����У���b mol��L��1�ĸ�����ر�Һ�ζ�������ζ��յ�ʱ�����ĸ������VmL����M =__________��(��֪�����ַ�Ӧ����ΪMn2+��Fe3+��CO2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���о���������������ʱ���ı������Կ��淴Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)����H<0��Ӱ�졣����˵����ȷ����
2SO3(g)����H<0��Ӱ�졣����˵����ȷ����

A. ͼ1�о������¶ȡ�ѹǿ��ƽ���Ӱ�죬�����ʾѹǿ
B. ͼ2�о������¶ȶ�ƽ���Ӱ�죬�����õ��¶ȸ���
C. ͼ3��t0ʱʹ���˴�����ʹƽ��������Ӧ�����ƶ�
D. ͼ4��t0ʱ����ѹǿ��ʹƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ������������̽��Fe3+��ˮ��Һ�е���Ϊ��
���ϣ�i��Fe3+ ��ˮ��Һ����ˮ������������ʽ���ڣ���[Fe(H2O)6]3+��
[Fe(H2O)6]3+��������ˮ�ⷴӦ��
[Fe(H2O)6]3+(������ɫ)+nH2O![]() [Fe(H2O)6-n(OH)n]3-n(��ɫ)+nH3O+(n=0��6)��
[Fe(H2O)6-n(OH)n]3-n(��ɫ)+nH3O+(n=0��6)��
ii.[FeCl4(H2O)2]-Ϊ��ɫ��
��ʵ��I��

��ʵ��II��
�ֱ����Թ��������е��Լ���Ϊ����Һ����ɫ�ȼ�����������������ԽС����Һ��ɫԽ�����Խ������Һ��ɫԽdz��


ͼ1 ͼ2
Fe(NO3)3��Һ�������¶ȱ仯���� FeCl3��Һ�������¶ȱ仯����
��1��ʵ��I�У��Թ�����Һ��Ϊ��ɫ��ԭ���� ��
��2��ʵ��I�У��Թ�����Һ���ػ�ɫ��[FeCl4(H2O)2]-�йأ�֧�ִ˽��۵�ʵ�������� ��
��3����ʵ��IIͼ1��2��֪������ʱ����Һ��ɫ ��������dz�����������������������
��4����ʵ��II�����Եó����½��ۣ�
[����һ]FeCl3��Һ�д���������Ӧ��[FeCl4(H2O)2]-+4H2O![]() [Fe(H2O)6]3++4Cl-
[Fe(H2O)6]3++4Cl-
�ó��˽��۵������� ��
[���۶�] ����һ�з�Ӧ����H ������>0������<0������
��5��ʵ��С��ͬѧ���������һ��ʵ��֤����4���н���һ��ʵ�鷽����ȡ�Թ�������Һ�� ����������Ҫ��ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڿ����¹ڷ��Ĺ����У�������Ա�о��˷�ƥ��Τ������Τ�֡�����������ҩ�����Ч������ҩ����Ҫ�ɷֵĽṹ��ʽ���¡�����˵������ȷ����
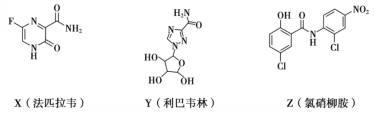
A.X�ķ���ʽΪC5H4O2N3F
B.Z�к���6�ֹ�����
C.Y��Z�����ǻ��������ʲ���ȫ��ͬ
D.X��Z���ܷ����ӳɷ�Ӧ��ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298Kʱ��Ksp(MnS)=4.65��1014��Ksp(MnCO3)=2.24��1011��298K�£�MnS��MnCO3(R2����S2��CO32-)��ˮ�е��ܽ�������ͼ��ʾ������˵����ȷ����
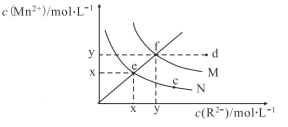
A.ͼ����xԼ����2.2��107
B.�����������䣬����N������Һ��ʹ��Һ�����e����ef����f�㷽���ƶ�
C.�����£���ˮϡ��M��Һ��ʹ��Һ�����d����df����f�㷽���ƶ�
D.����MnS��MnCO3�ı�����Һ�м�����MnCl2��![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)+O2(g)![]() 2SO3(g)����H=-198kJ/mol���� V2O5����ʱ��Ӧ�����е������仯��ͼ��ʾ������������ȷ����
2SO3(g)����H=-198kJ/mol���� V2O5����ʱ��Ӧ�����е������仯��ͼ��ʾ������������ȷ����
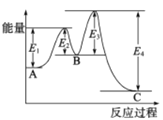
A. ��H= E4- E3+E2-E1
B. ����V2O5��Ӧ����������������е�һ��������Ӧ����
C. ����V2O5����H����������Ӧ���ʸı�
D. ���ܱ������г���2molSO2��1molO2������������Ӧ��ƽ��ʱ����Ӧ����198kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com