
【题目】下列关于有机物的说法不正确的是( )
A. 除去乙酸乙酯中混有的乙酸,可以用饱和碳酸钠溶液
B. 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同
C. 聚合物![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
D. C3H2Cl6有4种同分异构体
【答案】B
【解析】A.因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑,故A正确;B. 顺-2-丁烯与反-2-丁烯与氢气加成的产物均为正丁烷,故B错误;C.由CH3CH=CH2和CH2=CH2加聚制得![]() ,故C正确;D.丙烷的二氯代物的异构体为:CHCl2CH2CH3,CH3CCl2CH3,CH2ClCHClCH3,CH2ClCH2CH2Cl,丙烷有8个H原子,其中2个H原子被氯原子取代形成丙烷的二氯代物,六氯代物可以看作C3Cl8中的8个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的,二氯代物有4种同分异构体,可得到六氯代物也有4种同分异构体,故D正确;答案为B。
,故C正确;D.丙烷的二氯代物的异构体为:CHCl2CH2CH3,CH3CCl2CH3,CH2ClCHClCH3,CH2ClCH2CH2Cl,丙烷有8个H原子,其中2个H原子被氯原子取代形成丙烷的二氯代物,六氯代物可以看作C3Cl8中的8个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的,二氯代物有4种同分异构体,可得到六氯代物也有4种同分异构体,故D正确;答案为B。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,回答下列问题:

(1)甲池是___________(填“原电池”、“电解池”或“电镀池”)装置,乙装置中电极A的名称是_______(填“正极”、“负极”、“阴极”或“阳极”)。
(2)甲装置中通入CH4的电极反应式为__________________________________,乙装置中电极B(Ag)的电极反应式为________________________________,丙装置中D极的产物是____________(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O =4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为______。
(2)NO中氮原子轨道的杂化类型是______。
(3)与HNO2互为等电子体的一种阴离子的化学式为______。
(4)配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是______。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有______。
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》
(1) 2017年10月22日,沪通长江大桥天生港航道桥主拱结构成功合龙。
①桥墩建造需要用到大量水泥。生产水泥的主要原料为黏土和____(填字母)。
a. 纯碱 b. 石灰石 c. 食盐

②氯丁橡胶作为桥梁支座,其作用是将桥跨结构上的荷载传递给墩台。氯丁橡胶属于____(填字母)。
a. 无机非金属材料
b. 金属材料
c. 有机高分子材料
③桥梁建造需要使用大量钢材,其中预埋钢板及上、下钢板均采用镀锌钢板,钢板镀锌的主要目的是____(填字母)。
a. 美化桥梁 b. 提高硬度 c. 提高耐腐蚀性
(2)洋蓟被人们冠以“蔬菜之皇”的美称,含有脂肪、蛋白质、糖类、维生素A、维生素C和丰富的钙、磷、铁等元素,其中:

①属于脂溶性维生素的是____。
②属于人体所需微量元素的是____。
③脂肪在人体内水解生成高级脂肪酸和____;糖类在人体中水解生成葡萄糖,写出葡萄糖在人体内氧化的化学方程式: ____。
(3)合理利用自然资源,防止环境污染和生态破坏。
①向燃煤中加入适量石灰石,可大大减少______的排放。煤的气化是实现能源清洁化的重要途径,水煤气的主要成分是CO和______。
②明矾是一种常用的混凝剂,其净水原理是___________(用离子方程式表示)。
③我国科学家证明了黄粉虫的幼虫可降解聚苯乙烯(![]() )这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:________________。防治废塑料制品造成的白色污染,还可以采用的方法有:__________(任写一种)。
)这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:________________。防治废塑料制品造成的白色污染,还可以采用的方法有:__________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
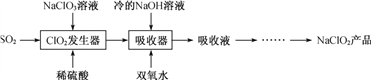
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明: ![]() 不稳定,不考虑)
不稳定,不考虑)
请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知, ![]() ,则
,则![]() 和
和![]() 等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
(5)常温下, ![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() 的电离平衡常数Ka_______________。
的电离平衡常数Ka_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的氧化物是形成酸雨的罪魁祸首,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH+Ca2++2OH-+SO![]() ===CaSO3↓+2NH3·H2O。
===CaSO3↓+2NH3·H2O。
(1)已知:25 ℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=__________(用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:ⅰ.2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
ⅱ.2H2(g)+SO2(g) ![]() S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
(2)写出CO(g)与H2O(g)反应生成CO2(g) 、H2(g)的热化学方程式为_______________。
若该反应在绝热、恒容体系中进行,达到平衡的标志___________。
A.氢氧键的断裂速率等于氢氢键的断裂速率
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D. H2O(g) 与H2(g)的体积比保持不变
(3)反应ⅱ的正反应的活化能E________(填“>”“<”或“=”)ΔH2。
(4)在一定压强下,发生反应ⅱ。平衡时,α(SO2) (二氧化硫的转化率)与原料气投料比[![]() ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。

①α(H2):M________(填“>”“<”或“=”)N。
②逆反应速率:M________(填“>”“<”或“=”)Q。
(5)T ℃,向10 L恒容密闭容器中充入2 mol CO(g)、2 mol SO2(g)和2 mol H2(g),发生反应ⅰ和反应ⅱ。5 min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应ⅱ的平衡常数K=________。
②其他条件不变,6 min时缩小容器容积。α(SO2)__________(填“增大”“减小”或“不变”),原因为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态N2O4是火箭推进系统的有效氧化剂。实验室制备少量N2O4的流程如下:
![]()
下列分析正确的是
A. 反应①、③中氮元素的化合价发生了变化
B. 反应②利用了NH3的氧化性
C. 反应④的颜色变化是由化学平衡移动引起的
D. 反应①可由图所示装置实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com