
某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6===6C+LiCoO2,其电池如图所示。下列说法不正确的是
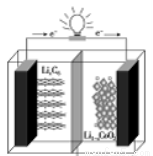
A.放电时,LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时将电池的负极与外接电源的负极相连阳离子交换膜
D.放电时,电池的正极反应为Li1-xCoO2+xLi++xe-===LiCoO2
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.SO42-的摩尔质量为96g mol-1
B.1mol物质的质量等于该物质的式量
C.1molO2的质量为32 g mol-1
D.CO2的摩尔质量为44g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:填空题
(15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源

(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,
试写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/LHA溶液的pH>1,0.1mol/LBOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为: c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,离子反应方程式为:
3SO2+2NO3-+3Ba2++2H2O 3BaSO4↓+2NO↑+4H+
3BaSO4↓+2NO↑+4H+
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:填空题
(15分)甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
方法一 | CO(g) +2H2(g) |
方法二 | CO2(g) +3H2(g) |
(1)已知:① 2CH3OH(l) + 3O2(g)  2CO2(g) + 4H2O(g) △H=-1275.6 kJmol-1
2CO2(g) + 4H2O(g) △H=-1275.6 kJmol-1
② 2CO(g) + O2(g)  2CO2(g) △H=-566.0 kJmol-1
2CO2(g) △H=-566.0 kJmol-1
③ H2O(l) = H2O(g) △H = + 44.0 kJmol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为 。
(2)方法一生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%。请回答下列问题:
①前5分钟内甲醇的平均反应速率为 ;已知该反应在低温下能自发进行,则反应的
△H为 (填“>”、“<”或 “=”)0。
②在该温度下反应的平衡常数K= 。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正 ν逆(填“>”“=”“<”)。
(3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。

①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色变化是 。
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为 (法拉第常数F=9.65×l04C · mol-1)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
(12分)由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了。全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的电子排布式 。
(2)与CO2互为等电子体的一种离子为 (填化学式)。
(3)NH3分子中氮原子的杂化轨道类型是 。
(4)1 mol CH3COOH中含有的σ键的数目为 。
(5)TiO2的天然晶体中,最稳定的一种晶体结构如图,黑球表示 原子。

(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物(如上图),该化合物中Fe2+与环戊二烯基离子之间以 相结合(填字母)。
a.离子键
b.金属键
c.配位键
d.氢键
e.范德华力
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲线如图所示。下列说法正确的是

A.点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-)
C.点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在整个滴定过程中:溶液中 始终不变
始终不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O2- 7与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 (填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O2- 7发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式 。
(5)电解法中加入氯化钠的作用是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:选择题
下列叙述涉及的化学相关知识,其中不正确的是
①打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释
②化学键可以使离子相结合,也可以使原子相结合
③用铁制自来水管与铜制水龙头连接使用时,连接处的铁水管锈蚀更快
④Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关
⑤氟利昂(CF2Cl2)会破坏大气臭氧层,从而导致“温室效应”
⑥Al和Fe在一定条件下都能与某些氧化物反应
⑦一定条件下,仅用稻草就可制得酒精和氨基酸
⑧汽油和花生油的主要成份都是油脂
A.④⑤⑦⑧ B.③④⑤⑧ C.①②③⑥ D.①④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com