
【题目】一定条件下的可逆反应CO(g)+2H2(g)![]() CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
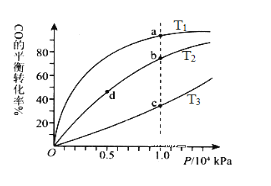
A.温度:T1< T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ;K(b) >K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
【答案】A
【解析】
A.该反应的正反应方向是放热反应,随着温度的升高,平衡向逆反应方向进行,CO的转化率降低,因此根据图像,在相同压强下,得出T1<T2<T3,故A说法正确;
B.a点和c点相比,压强相同,a点对应的温度小于c点温度,温度越高,反应速率越大,即v(a)<v(c),对比bd两点,具有相同的温度,但b点压强大于d点,压强越大,反应速率越大,即v(b)>v(d),故B说法错误;
C.平衡常数只受温度的影响,该反应为放热反应,升高温度,化学平衡常数降低,a点温度低于c点,因此K(a)>K(c),bd温度相同,则K(b)=K(d),故C说法错误;
D.根据![]() 进行分析,组分都是气体,开始时通入量相同,因此混合气体质量相同,CO转化率越大,气体总物质的量越小,a点气体总物质的量最小,即M(a)>M(c),M(b)>M(d),故D说法错误;
进行分析,组分都是气体,开始时通入量相同,因此混合气体质量相同,CO转化率越大,气体总物质的量越小,a点气体总物质的量最小,即M(a)>M(c),M(b)>M(d),故D说法错误;
答案:A。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】在A、B两个恒容密闭容器中发生反应:2NO22NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示:
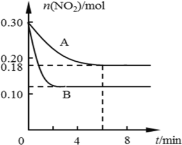
(1)若A容器的体积为5 L,反应经6 min达到平衡状态,则0~6 min内以O2浓度变化表示的反应速率为___________。
(2)该反应化学平衡常数K=__________(写出表达式)。
(3)说明该反应已达到平衡状态的是_______。
A.v正(NO2)=v逆(NO)B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(4)若A、B两容器中只是温度不同,则TA____TB (填“>”或“<”),请写出一条能提高二氧化氮转化率的措施_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】骨胶黏剂是一种极具应用前景的医用高分子材料。某骨胶黏剂的制备原料为聚酯三元醇,其合成原理如下:
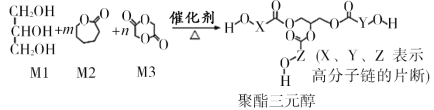
已知:R1COOR2+R318OH![]() R1CO18OR3+R2OH
R1CO18OR3+R2OH
下列说法正确的是
A.单体Ml可用于配制化妆品,且分子中含有3个手性碳原子
B.改变Ml在三种单体中的比例,可调控聚酯三元醇的相对分子质量
C.该合成反应为缩聚反应
D.X、Y、Z中包含的结构片段可能有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列有机物中,经催化加氢后不能生成2﹣甲基戊烷的是
A.CH2=C(CH3)CH2CH2CH3B.CH2=CHCH(CH3)CH2CH3
C.CH3C(CH3)=CHCH2CH3D.CH3CH=CHCH(CH3)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a L NH3通入某恒压的密闭容器中,在一定条件下让其分解,达到平衡后气体体积增大到b L(气体体积在相同条件下测定)。下列说法中正确的是( )
A.平衡后氨气的分解率为![]()
B.平衡混合气体H2的体积分数为![]()
C.反应前后气体的密度比为![]()
D.平衡后气体的平均摩尔质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
(提出猜想)小组提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)查阅资料得知,NO2可被NaOH溶液吸收,反应的化学方程式为:____________.
(2)实验前,小组成员经讨论认定猜想丁不成立,理由是____________.
(实验操作)
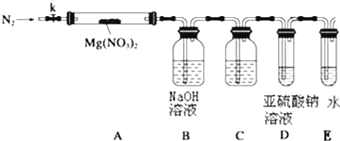
(3)设计如图装置,用氮气排尽装置中空气,其目的是___________;加热Mg(NO3)2固体,AB装置实验现象是:____________,说明有Mg(NO3)2固体分解了,有NO2生成.
(4)有同学提出可用亚硫酸钠溶液检验是否有氧气产生,但通入之前,还需在BD装置间增加滴有酚酞的氢氧化钠溶液,其作用是:____________
(5)小组讨论后认为即便通过C后有氧气,仅仅用亚硫酸钠溶液仍然难以检验,因为:____________,改进的措施是可在亚硫酸钠溶液中加入____________.
(6)上述系列改进后,如果分解产物中有O2存在,排除装置与操作的原因,未检测到的原因是____________.(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=2 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com