
【题目】下图为利用肼(N2H4)一空气燃料电池电解硫酸铜溶液的示意图。下列说法正确的是( )
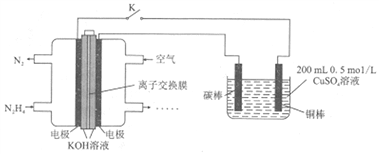
A. 左图中离子交换膜为阳离子交换膜
B. 左图负极反应式为:N2H4-6e-+4OH-=N2↑+4H2O
C. 闭合开关K一段时间后,左图电池中电解质溶液的pH不变
D. 当右图阴极上析出4.48L气体(标准状况)时,消耗0.15molN2H4
【答案】D
【解析】该原电池中,正极上生成氢氧根离子,所以离子交换膜要选取阴离子交换膜, A错误;通入燃料的电极为负极,负极上N2H4失电子发生氧化反应,电极反应式为: N2H4-4e-+4OH-=N2↑+4H2O , B错误;闭合开关K一段时间后,左图电池中负极极反应为:N2H4-4e-+4OH-=N2↑+4H2O,正极极反应:O2+2H2O+4e-=4OH-,反应前后氢氧化钾溶质的量不变,但是反应发生后,有水生成,溶液体积变大,氢氧根离子浓度变小,pH减小,C错误;右图装置为电解池,碳棒为阳极,铜棒为阴极,电解硫酸铜溶液,阴极极反应①:Cu2++2e-=Cu铜离子的总量为0.2×0.5=0.1 mol,转移电子0.2 mol;②:2H++2e-=H2↑当生成氢气为4.48/22.4=0.2mol,转移电子为0.4 mol, 阴极极反应共转移电子0.6mol,根据串联电路电子转移总数相等规律,根据原电池负极极反应:N2H4-4e-+4OH-=N2↑+4H2O可知,消耗N2H4的量为0.15 mol,D正确;正确选项D。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 不能求出硝酸的物质的量浓度 B. 氢氧化钠溶液浓度为3mol/L
C. 可以求出合金中镁的质量 D. 可以求出沉淀的最大质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g)![]() -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g )![]() N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g)![]() 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g) ![]() 2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
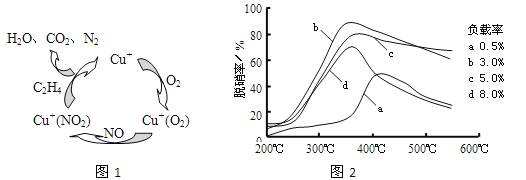
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
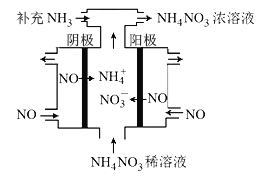
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生析氢腐蚀时,正极上发生的电极反应是
A. 2H++2e-=H2↑ B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)。
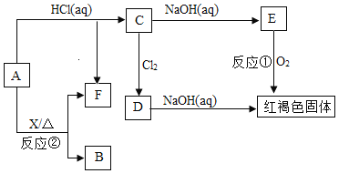
请根据以上信息回答下列问题:
(1)写出物质B的化学式:________。
(2)写出下列反应的化学方程式:
反应①______________________________________。
反应②_______________________________________。
(3)写出下列反应的离子方程式:反应C→D________________________。
(4)检验D中阳离子的方法:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的恒温恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
A. c1:c2=1:2 B. 平衡时,Y和Z的生成速率之比为2:3
C. 若反应正向进行,X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某碳酸溶液中的H2CO3、HCO3-、CO23-的物质的量分数δ随pH的变化如下图所示。下列叙述错误的是( )
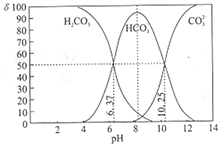
A. 当溶液中δ(HCO3-)达到最大时:c(H2CO3)>c(CO32-)
B. Ka2(H2CO3)的数量级为10-11
C. 调节溶液的pH由8~10的过程中![]() 减小
减小
D. 加入NaOH使溶液pH=9时,主要反应为HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A.CaCl2、NaOH、HCl、HD四种物质都属于化合物
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.溶液,浊液,胶体都属于混合物
D.CO2、CO等非金属氧化物均属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com