
【题目】Ⅰ. 依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧的热化学方程式为________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为_______________________。
Ⅱ.(1)下列事实能用化学平衡移动来原理解释的是 _________
A.打开冰啤酒瓶盖,看到瓶中啤酒冒出大量气泡
B.对反应2NO2(g)![]() N2O4(g), 压缩体积平衡体系颜色变深
N2O4(g), 压缩体积平衡体系颜色变深
C.对SO2催化氧化成SO3的反应,往往加入过量的空气提高SO2转化率
(3)在一定条件下,将H2和N2置于容积为2 L的密闭容器中发生N2(g) + 3H2(g) ![]() 2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g)
2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g)![]() N2(g) + 3H2(g)的平衡常数为____________;
N2(g) + 3H2(g)的平衡常数为____________;
【答案】 CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1 A、C 0.94
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1 A、C 0.94
【解析】本题主要考查化学平衡的移动、判断及计算。
Ⅰ. (1)在25 ℃、101 kPa下,32 g即1mol液态甲醇燃烧生成CO2和液态水时放热725.76 kJ。则表示甲醇燃烧的热化学方程式为CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
(2)C2H2~10e-,每有5NA个电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1。
Ⅱ.(1)下列事实能用化学平衡移动来原理解释的是 AC。
A.打开冰啤酒瓶盖,气压减小,二氧化碳的溶解平衡左移,二氧化碳的溶解度减小,瓶中啤酒冒出大量气泡,故A能用化学平衡移动来原理解释;B.对反应2NO2(g)![]() N2O4(g), 压缩体积,气体浓度增大,平衡体系颜色变深,故B不能用化学平衡移动来原理解释;C.对SO2催化氧化成SO3的反应,加入过量的空气,反应物氧气的浓度增大,平衡右移,提高SO2转化率,故C能用化学平衡移动来原理解释。故选AC。
N2O4(g), 压缩体积,气体浓度增大,平衡体系颜色变深,故B不能用化学平衡移动来原理解释;C.对SO2催化氧化成SO3的反应,加入过量的空气,反应物氧气的浓度增大,平衡右移,提高SO2转化率,故C能用化学平衡移动来原理解释。故选AC。
(3)平衡时,设消耗N2xmol,则(0.80+1.60-2x)20%=2x,x=0.2。c(N2)=0.3mol/L,c(H2)=0.5mol/L,c(NH3)=0.2mol/L,相同温度下反应2NH3(g)![]() N2(g) + 3H2(g)的平衡常数为
N2(g) + 3H2(g)的平衡常数为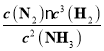 =0.94。
=0.94。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】利用电导法测定某浓度醋酸电离的ΔH、Ka随温度变化曲线关系如图。已知整个电离过程包括氢键断裂、醋酸分子解离、离子水合。下列有关说法不正确的是
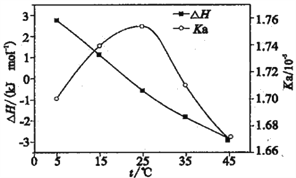
A. 理论上ΔH=0时,Ka最大
B. 25℃时,[CH3COOH]最大
C. 电离的热效应较小是因为分子解离吸收的能量与离子水合放出的能量相当
D. CH3COOH溶液中存在氢键是ΔH随温度升高而减小的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
A. 若w1=2w2,则c1<2c2,V=50 mL
B. 若w1=2w2,则c1>2c2,V<50 mL
C. 若c1=2c2,则w1<2w2,V<50 mL
D. 若c1=2c2,则w1<2w2,V>50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
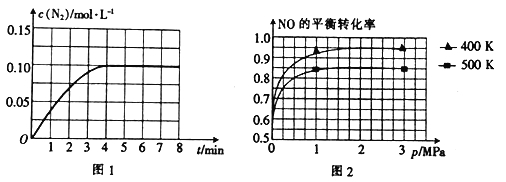
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________,4 min末CO的浓度为_____________ molL-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于加成反应的是( )
A.乙烯通入酸性高锰酸钾溶液中
B.乙烯通入溴水中
C.苯与液溴在FeBr3催化下反应
D.甲烷与氯气在一定条件下反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com