
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________。
(3)E的最高价氧化物分子的空间构型是__________,是____分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________。(a)中E原子的配位数为____。若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有____个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)____(b)(填“>”“<”或“=”)。

【答案】 Na<Al<Si<N NaCl为离子晶体而SiCl4为分子晶体 平面正三角形 非极性 1s22s22p63s23p63d104s2(或[Ar] 3d104s2) ZnS 4 2 =
【解析】C元素是地壳中含量最高的金属元素,即C为Al,D单质的熔点在同周期元素形成的单质中最高,推出D为Si,F2+离子核外各层电子均充满,推出F为Zn,化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子,即E为S,B为Na,A原子核外有三个未成对电子,即A为N,(1)考查第一电离能,金属性越强,第一电离能越小,非金属性越强,第一电离能越大,Na的金属性强于Al,N的非金属性强于Si,因此第一电离能由小到大的顺序是Na<Al<Si<N;(2)考查晶体熔沸点高低,B的氯化物是NaCl,属于离子晶体,D的氯化物是SiCl4,属于分子晶体,一般情况下,离子晶体的熔沸点高于分子晶体;(3)考查空间构型和极性分子判断,E的最高价氧化物是SO3,有3个σ键,孤电子对数为(6-3×2)/2=0,价层电子对数为3,空间构型为平面正三角形,属于非极性分子;(4)考查电子排布式的书写,F为Zn,位于第四周期IIB族,即核外电子排布式为:1s22s22p63s23p63d104s2(或[Ar] 3d104s2);(5)考查晶胞计算,根据(a)S位于顶点和面心,个数为8×1/8+6×1/2=4,Zn位于体内,有4个,化学式为ZnS,根据(a)离S最近的Zn有4个,则S的配位数为4,在(b)的结构中取出一个平行六面体,结构是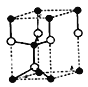 (空心球表示Zn原子), 含有锌原子的个数为4×1/4+1=2,a图种S2-之间形成面心立方堆积,b图种S2-形成六方最密堆积,这两种堆积方式的原子空间利用率相等。
(空心球表示Zn原子), 含有锌原子的个数为4×1/4+1=2,a图种S2-之间形成面心立方堆积,b图种S2-形成六方最密堆积,这两种堆积方式的原子空间利用率相等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
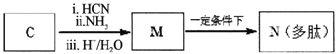
【题目】高分子化合物G是作为锂电池中Li十迁移的介质,合成G的流程如下:
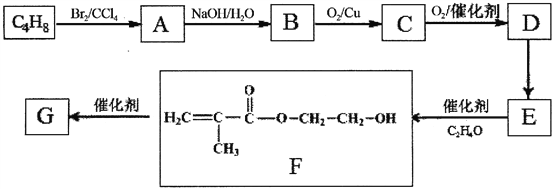
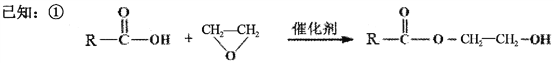
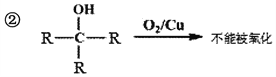
(1)B的含氧官能团名称是_____________________________________。
(2)A—B的反应类型是_____________________________________。
(3)C的结构简式是_____________________________________。
(4)D→E反应方程式是_____________________________________。
(5)G的结构简式是_____________________________________。
(6)D的一种同分异构体,能发生分子内酯化反应生成五元环状化合物,该同分异构体的结构简式是_____________________________________。
(7)已知: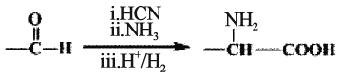
M—N的化学方程式是___________________________。
(8)下列说法正确的是_______________(填字母)。
a.E有顺反异构体
b.C能发生加成、消去反应
c.M既能与酸反应,又能与碱反应
d.苯酚与C反应能形成高分子化合物
e.含有—OH和—COOH的D的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上由左到右分别写了H2 , CO2 , Na2O,NaCl,FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A,B,C,D为其相应的分类依据代号. ![]()
请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
两种物质都是气体
两种物质都是钠的化合物
两种物质都是氧化物
两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体.
①物质M的化学式为 .
②证明有红褐色胶体生成的实验操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400 mL2 mol·L-1H2SO4溶液中,H+的物质的量浓度为_________,SO42-的物质的量浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成生物体的化学元素的说法中,正确的是
A. 哺乳动物血液中钙过多时会出现抽搐
B. C元素是活细胞中含量最多的元素
C. 玉米和人体内所含有的元素种类大体相同,含量相差也不大
D. Ca、H、K等大量元素在细胞中有重要作用,可维持多项正常的生命活动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,针对表中标出的①~⑩元素,请回答有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为;
(2)表中金属性最强的元素是(用元素符号表示,下同),非金属性最强的元素是 , 可作半导体材料的是元素的单质;
(3)表中能形成两性氢氧化物的元素是 , 写出该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式;
(4)⑨的最高价氧化物的水化物所含化学键类型;
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是(填化学式);
(6)元素①的最高价氧化物的电子式 , ④元素与⑦元素形成化合物的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过KOH溶液,使用前未洗涤
D.定容时俯视刻度线和液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com