
ЁОЬтФПЁПБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌеыЖдБэжаБъГіЕФЂйЁЋЂтдЊЫиЃЌЧыЛиД№гаЙиЮЪЬтЃК
зх | ЂёA | ЂђA | ЂѓA | ЂєA | ЂѕA | ЂіA | ЂїA | 0 |
2 | Ђй | Ђк | Ђл | |||||
3 | Ђс | Ђм | Ђн | Ђт | Ђо | Ђп | Ђр |
ЃЈ1ЃЉБэжаЛЏбЇаджЪзюВЛЛюЦУЕФдЊЫиЃЌЦфдзгНсЙЙЪОвтЭМЮЊЃЛ
ЃЈ2ЃЉБэжаН№ЪєадзюЧПЕФдЊЫиЪЧЃЈгУдЊЫиЗћКХБэЪОЃЌЯТЭЌЃЉЃЌЗЧН№ЪєадзюЧПЕФдЊЫиЪЧ ЃЌ ПЩзїАыЕМЬхВФСЯЕФЪЧдЊЫиЕФЕЅжЪЃЛ
ЃЈ3ЃЉБэжаФмаЮГЩСНадЧтбѕЛЏЮяЕФдЊЫиЪЧ ЃЌ аДГіИУдЊЫиЕФЕЅжЪгыЂсЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЗДгІЕФЛЏбЇЗНГЬЪНЃЛ
ЃЈ4ЃЉЂсЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЫљКЌЛЏбЇМќРраЭЃЛ
ЃЈ5ЃЉЂйЁЂЂоЁЂЂпШ§жждЊЫиЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяжаЫсадзюЧПЕФЪЧЃЈЬюЛЏбЇЪНЃЉЃЛ
ЃЈ6ЃЉдЊЫиЂйЕФзюИпМлбѕЛЏЮяЕФЕчзгЪН ЃЌ ЂмдЊЫигыЂпдЊЫиаЮГЩЛЏКЯЮяЕФЕчзгЪН ЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉ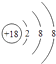
ЃЈ2ЃЉNaЃЛFЃЛSi
ЃЈ3ЃЉAlЃЛ2Al+2NaOH+2H2OЈT2NaAlO2+3H2Ёќ
ЃЈ4ЃЉРызгМќЁЂЙВМлМќ
ЃЈ5ЃЉHClO4
ЃЈ6ЃЉ![]() ЃЛ
ЃЛ![]()
ЁОНтЮіЁПНтЃКИљОндЊЫидкжмЦкБэЮЛжУжЊЃЌЂйЁЋЂтЗжБ№ЪЧдЊЫиCЁЂNЁЂFЁЂMgЁЂAlЁЂSЁЂClЁЂArЁЂNaЁЂSiдЊЫиЃЛ
ЃЈ1.ЃЉБэжаЛЏбЇаджЪзюВЛЛюЦУЕФдЊЫиЪЧArЃЌЦфдзгКЫЭтга3ИіЕчзгВуЁЂзюЭтВуЕчзгЪ§ЪЧ8ЃЌЦфдзгНсЙЙЪОвтЭМЮЊ 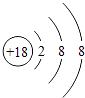 ЃЌЫљвдД№АИЪЧЃК
ЃЌЫљвдД№АИЪЧЃК 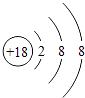 ЃЛ
ЃЛ
ЃЈ2.ЃЉБэжаН№ЪєадзюЧПЕФдЊЫиЮЛгкжмЦкБэзѓЯТНЧЮЊNaдЊЫиЃЌЗЧН№ЪєадзюЧПЕФдЊЫиЮЛгкжмЦкБэгвЩЯНЧЮЊFдЊЫиЃЌSiзїАыЕМЬхВФСЯЃЌЫљвдД№АИЪЧЃКNaЃЛFЃЛSiЃЛ
ЃЈ3.ЃЉБэжаФмаЮГЩСНадЧтбѕЛЏЮяЕФдЊЫиЪЧAlЃЌЂсЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЪЧNaOHЃЌAlКЭNaOHШмвКЗДгІЩњГЩЦЋТСЫсФЦКЭЧтЦјЃЌЗДгІЗНГЬЪНЮЊ2Al+2NaOH+2H2OЈT2NaAlO2+3H2ЁќЃЌЫљвдД№АИЪЧЃКAlЃЛ2Al+2NaOH+2H2OЈT2NaAlO2+3H2ЁќЃЛ
ЃЈ4.ЃЉЂсЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЪЧNaOHЃЌвѕбєРызгжЎМфДцдкРызгМќЁЂЗЧН№ЪєдЊЫижЎМфаЮГЩЙВМлМќЃЌФЦРызгКЭЧтбѕИљРызгжЎМфДцдкРызгМќЁЂOЉHдзгжЎМфДцдкЙВМлМќЃЌЫљвдД№АИЪЧЃКРызгМќЃЛЙВМлМќЃЛ
ЃЈ5.ЃЉдЊЫиЕФЗЧН№ЪєаддНЧПЃЌЦфзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЫсаддНЧПЃЌетМИжждЊЫиЗЧН№ЪєадзюЧПЕФЪЧClдЊЫиЃЌЦфзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЛЏбЇЪНЮЊHClO4 ЃЌ ЫљвдД№АИЪЧЃКHClO4ЃЛ
ЃЈ6.ЃЉдЊЫиЂйЕФзюИпМлбѕЛЏЮяЖўбѕЛЏЬМЃЌЖўбѕЛЏЬМЗжзгжаCКЭУПИіOдзгжЎМфЙВгУ2ЖдЕчзгЃЌЕчзгЪНЮЊ ![]() ЃЛЂмдЊЫигыЂпдЊЫиаЮГЩЛЏКЯЮяТШЛЏУОЃЌТШЛЏУОжаУОРызгКЭТШРызгжЎМфДцдкРызгМќЃЌЕчзгЪНЮЊ
ЃЛЂмдЊЫигыЂпдЊЫиаЮГЩЛЏКЯЮяТШЛЏУОЃЌТШЛЏУОжаУОРызгКЭТШРызгжЎМфДцдкРызгМќЃЌЕчзгЪНЮЊ ![]() ЃЌ
ЃЌ
ЫљвдД№АИЪЧЃК ![]() ЃЛ
ЃЛ ![]() ЃЎ
ЃЎ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиNa2CO3КЭNaHCO3аджЪЕФБШНЯжаЃЌе§ШЗЕФЪЧЃЈ ЃЉ
A.ЕШХЈЖШЕФШмвКжаЕЮШыЯЁбЮЫсЃЌЗХГіЦјЬхЕФПьТ§Na2CO3<NaHCO3
B.ШШЮШЖЈадNa2CO3<NaHCO3
C.ГЃЮТЪБЫЎШмадNa2CO3<NaHCO3
D.ЯрЖдЗжзгжЪСПNa2CO3<NaHCO3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдзгНсЙЙФЃаЭОРњСЫЮхИіжївЊНзЖЮЃК1803ФъНЈСЂдзгбЇЫЕЁњ1903ФъЁАЦЯЬбИЩВМЖЁЁБФЃаЭЁњ1911ФъКЫЪНФЃаЭЁњ1913ФъКЫЭтЕчзгЗжВуХХВМФЃаЭЁњ20ЪРМЭГѕСПзгСІбЇФЃаЭЁЃЬсГіКЫЭтЕчзгЗжВуХХВМЕФдзгНсЙЙФЃаЭЕФПЦбЇМвЪЧ( )
A.ВЃЖћB.ЬРФЗбЗC.ТЌЩЊИЃD.ЕРЖћЖй
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇгУгяБэЪОЯТСаЙ§ГЬ
ЃЈ1ЃЉNaHSO4дкШлШкзДЬЌЯТЕФЕчРыЃК___________ЁЃ
ЃЈ2ЃЉвбжЊЃКCЃЈs) + O2ЃЈg)![]() CO2ЃЈg) H1=a kJ/mol
CO2ЃЈg) H1=a kJ/mol
2COЃЈg) + O2ЃЈg)![]() 2CO2ЃЈg) H2=b kJ/mol
2CO2ЃЈg) H2=b kJ/mol
аДГіCЃЈs) КЭO2ЃЈg) зЊЛЏЮЊCOЃЈg) ЕФШШЛЏбЇЗНГЬЪНЃК______ЁЃ
вбжЊ25 ЁцЪБЃЌСНжжШѕЫсЕФЕчРыЦНКтГЃЪ§HCNЃКKaЃН4.9ЁС10Ѓ10ЃЌH2CO3ЃКKa1ЃН4.4ЁС10Ѓ7ЃЌKa2ЃН4.7ЁС10Ѓ11ЃЌЯђNaCNШмвКжаЭЈШыЩйСПCO2ЗДгІЕФРызгЗНГЬЪНЃК__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКжмЦкБэжаЧАЫФжмЦкЕФСљжждЊЫиAЁЂBЁЂCЁЂDЁЂEЁЂFКЫЕчКЩЪ§вРДЮдіДѓЃЌЦфжаAдзгКЫЭтгаШ§ИіЮДГЩЖдЕчзгЃЛЛЏКЯЮяB2EЕФОЇЬхЮЊРызгОЇЬхЃЌEдзгКЫЭтЕФMВужажЛгаСНЖдГЩЖдЕчзгЃЛCдЊЫиЪЧЕиПЧжаКЌСПзюИпЕФН№ЪєдЊЫиЃЛDЕЅжЪЕФШлЕудкЭЌжмЦкдЊЫиаЮГЩЕФЕЅжЪжаЪЧзюИпЕФЃЛF2+РызгКЫЭтИїВуЕчзгОљГфТњЁЃЧыИљОнвдЩЯаХЯЂЃЌЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉAЁЂBЁЂCЁЂDЕФЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЮЊ____ЁЃЃЈгУдЊЫиЗћКХБэЪОЃЉ
ЃЈ2ЃЉBЕФТШЛЏЮяЕФШлЕуБШDЕФТШЛЏЮяЕФШлЕуИпЃЌРэгЩЪЧ____________________ЁЃ
ЃЈ3ЃЉEЕФзюИпМлбѕЛЏЮяЗжзгЕФПеМфЙЙаЭЪЧ__________ЃЌЪЧ____ЗжзгЃЈЬюЁАМЋадЁБЁАЗЧМЋадЁБЃЉЁЃ
ЃЈ4ЃЉFдзгЕФКЫЭтЕчзгХХВМЪНЪЧ________________ЁЃ
ЃЈ5ЃЉEЁЂFаЮГЩФГжжЛЏКЯЮягаШчЭМЫљЪОСНжжОЇЬхНсЙЙЃЈЩюЩЋЧђБэЪОFдзгЃЉЃЌЦфЛЏбЇЪНЮЊ_________ЁЃЃЈaЃЉжаEдзгЕФХфЮЛЪ§ЮЊ____ЁЃШєдкЃЈbЃЉЕФНсЙЙжаШЁГівЛИіЦНааСљУцЬхзїЮЊОЇАћЃЌдђЦНОљвЛИіОЇАћжаКЌга____ИіFдзгЁЃНсЙЙЃЈaЃЉгыЃЈbЃЉжаОЇАћЕФдзгПеМфРћгУТЪЯрБШЃЌЃЈaЃЉ____ЃЈbЃЉЃЈЬюЁАЃОЁБЁАЃМЁБЛђЁАЃНЁБЃЉЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇдкЩњЛюжагазХживЊЕФгІгУЁЃЯТСаа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ
A.ШМУКжаМгШыЩњЪЏЛвПЩвдМѕЩйЫсгъЕФаЮГЩ
B.ИпДПЖШЕФЖўбѕЛЏЙшЙуЗКгУгкжЦзїЙтЕМЯЫЮЌ
C.ЛЈЩњгЭжаЕФжївЊГЩЗжЪєгкѕЅРрЃЌЪЧЬьШЛИпЗжзгЛЏКЯЮя
D.ЬМФЩУзЙмБэУцЛ§ДѓЃЌПЩгУзїаТаЭДЂЧтВФСЯ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк0.1 molЁЄL-1 CH3COOHШмвКжаДцдкШчЯТЕчРыЦНКтЃКCH3COOH![]() CH3COO-+H+ЃЌЖдгкИУЦНКтЃЌЯТСаа№Ъіе§ШЗЕФЪЧ( )
CH3COO-+H+ЃЌЖдгкИУЦНКтЃЌЯТСаа№Ъіе§ШЗЕФЪЧ( )
A. МгШыЩйСП0.1 molЁЄL-1 HClШмвКЃЌШмвКжаc(H+)ВЛБф
B. МгШыЫЎЯЁЪЭЪБЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌШмвКжаЫљгаРызгЕФХЈЖШЖММѕаЁ
C. МгШыЩйСПCH3COONaЙЬЬхЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЦНКтГЃЪ§БфДѓ
D. МгШыЩйСПNaOHЙЬЬхЃЌДйНјСЫДзЫсЕФЕчРыЃЌШмвКжа![]() БфДѓ
БфДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВЛПЩгУгкБШНЯFКЭClЗЧН№ЪєадЕФЪЧЃЈ ЃЉ
A.ШмвКpHжЕЃКNaF>NaCl
B.ЙВМлМќМЋадЃКC-F>C-Cl
C.ЕЅжЪбѕЛЏадЃКF2>Cl2
D.ЧтЛЏЮяЮШЖЈадЃКHF>HCl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкУїЗЏЕФЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЛЏбЇЪНЮЊKAl(SO4)2ЁЄ12H2O B. ЪєгкЛьКЯЮя
C. ЪЧвЛжжСђЫсбЮ D. ЫЎШмвКФмЕМЕч
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com