
【题目】研究硫元素及其化合物的性质具有重要意义。
Ⅰ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
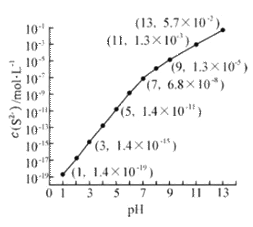
Ⅱ.在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(Q>0)
2SO3(g)(Q>0)
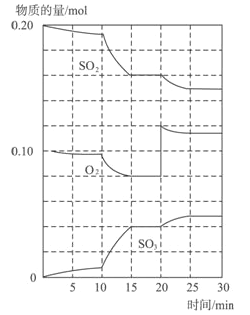
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____________。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是______________(用文字表达)10min到15min的曲线变化的原因可能是______________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
【答案】Ⅰ.(1)①0.043 ② 5
Ⅱ.(1)15—20min和 25-30min (正确但不全给1分)
(2)增加了氧气的量(或者说出0.04 mol的O2) a、b(正确但不全给1分)
【解析】
试题分析:(1)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol/LH2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1mol/L-5.7×10-2mol/L =0.043mol/L;
②Mn2+开始沉淀溶液中硫离子浓度为![]() ,因此根据图像可知此时pH=5;
,因此根据图像可知此时pH=5;
Ⅱ.(1)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态;
(2)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度。由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变。a.加了催化剂,增大反应速率,a正确;b.缩小容器体积,增大压强,增大反应速率,b正确;c.降低温度反应速率降低,c错误;d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,d错误,答案选ab。


科目:高中化学 来源: 题型:
【题目】ag铁粉与含有H2SO4的CuSO4溶液恰好完全反应后,得到ag铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.5∶2
B.7∶1
C.3∶8
D.8∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关1molNaOH的说法中,正确的是
A. NaOH的摩尔质量为40g
B. 1mol NaOH 的质量为40g/mol
C. 标准状况下,1molNaOH 所占的体积为22.4L
D. 将1molNaOH溶于水配成100mL溶液,则溶液中溶质的物质的量浓度为10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
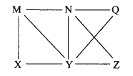
A. N一定是HCl(aq) B. X可能为Al或Cl2
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH和ROH分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
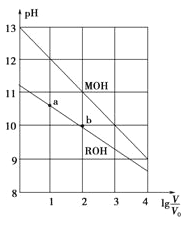
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是( )
A. 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++2Cl﹣+Cl2↑+2H2O
Mn2++2Cl﹣+Cl2↑+2H2O
B. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C. 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓
D. 向次氯酸钠溶液中通入SO2:2ClO+SO2+H2O=SO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 元素的电负性越大,其单质越稳定
B. 分子晶体中可能不存在共价键
C. 晶格能越大,形成的离子晶体越稳定
D. 金属晶体和离子晶体均具有延展性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com