
【题目】下列说法正确的是
A. 元素的电负性越大,其单质越稳定
B. 分子晶体中可能不存在共价键
C. 晶格能越大,形成的离子晶体越稳定
D. 金属晶体和离子晶体均具有延展性
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
Ⅰ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
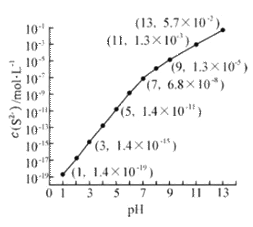
Ⅱ.在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(Q>0)
2SO3(g)(Q>0)
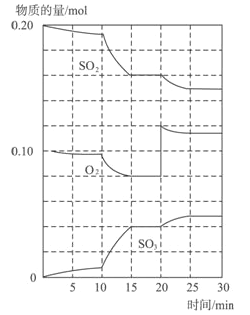
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____________。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是______________(用文字表达)10min到15min的曲线变化的原因可能是______________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 常温常压下,用铁和浓硫酸制取SO2气体
B. 用酸性高锰酸钾溶液鉴别环己烷和甲苯
C. 用饱和碳酸氢钠溶液除去O2中混有的少量HCl气体
D. 用分液漏斗分离苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合图的是

A.CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O ΔH<0
CO(NH2)2(s)+H2O ΔH<0
B.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
C.CH3CH2OH(g)![]() CH2=CH2(g)+H2O(g) ΔH>0
CH2=CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g)![]() 2C6H5CH=CH2(g)+2H2O(g) ΔH<0
2C6H5CH=CH2(g)+2H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当0.01mol氯化铬(III)(CrCl3·6H2O)在水溶液中用过量的硝酸银处理时,有0.02mol氯化银沉淀析出,此样品的配离子的表示式为
A. [Cr(H2O)6]3+ B. [CrCl(H2O)5]2+ C. [CrCl2(H2O)4]+ D. [CrCl3(H2O)3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )

A.MOH的电离方程式:MOH=M++OH-
B.该混合溶液中水电离出的c(H+)<10-7mol·L-1
C.该混合溶液中:c(Y)+c(X)=c(R)+c(Z)
D.图中c(X)+c(Z)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,则无色溶液中( )
A.只有Na+
B.一定有Na+ , 可能有K+
C.一定有Na+和K+
D.可能有Na+和K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com